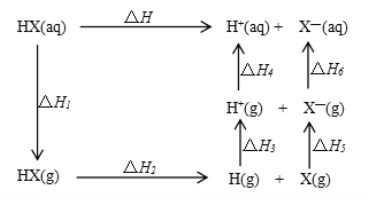
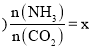题目内容
【题目】为测定某![]() 溶液的浓度,取
溶液的浓度,取![]() 该溶液于锥形瓶中,加入适量稀
该溶液于锥形瓶中,加入适量稀![]() 后,用浓度为c
后,用浓度为c![]()
![]() 标准溶液滴定。
标准溶液滴定。
(1)其反应的离子方程式为______![]() ______
______![]() ______
______![]() ______
______![]() ______
______
(2)滴定时,![]() 溶液应装在______
溶液应装在______![]() 填“酸式滴定管”或“碱式滴定管”
填“酸式滴定管”或“碱式滴定管”![]() 中,达到滴定终点的现象为______
中,达到滴定终点的现象为______
(3)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度______![]() 填“偏高”“偏低”“无影响”
填“偏高”“偏低”“无影响”![]()
(4)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为______![]()
(5)在该溶液与KOH溶液反应所得的![]()
![]() 溶液中,
溶液中,![]() ,下列关系正确的是______
,下列关系正确的是______
A.![]()
B.![]()
![]()
C.![]()
D.![]()
【答案】2 5 6 2 ![]() 酸式滴定管 滴入一滴
酸式滴定管 滴入一滴![]() 溶液变成紫色
溶液变成紫色![]() 或红色
或红色![]() 且半分钟不褪色
且半分钟不褪色 ![]()
![]() BD
BD
【解析】
(1)草酸被酸性高锰酸钾氧化生成二氧化碳,据氧化还原反应中电子守恒、原子守恒和电荷守恒配平;
(2)高锰酸钾具有强氧化性,应装在酸式滴定管中,KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去;
(3)根据所用过程判断不当操作对相关物理量的影响;
(4)注意参加反应的高锰酸钾与草酸的物质的量之比为2:5,据c(待测)=![]() ×
×![]() 求算;
求算;
(5)在KHC2O4溶液中c(C2O42-)>c(H2C2O4),说明HC2O4-的电离程度大于其水解程度,溶液显酸性,结合电荷守恒、物料守恒分析。
(1)草酸被酸性高锰酸钾氧化生成二氧化碳,1mol草酸反应转移2mol电子,1mol高锰酸钾反应转移5mol电子,其物质的量之比为5:2,再据原子守恒和电荷守恒配平的离子方程式为:![]() ;
;
(2)高锰酸钾具有强氧化性,应装在酸式滴定管中,草酸与酸性高锰酸钾发生氧化还原反应,当滴定到终点时,二者恰好完全反应,再滴入一滴![]() 溶液变成紫色
溶液变成紫色![]() 或红色
或红色![]() 且半分钟不褪色,可说明达到滴定终点;
且半分钟不褪色,可说明达到滴定终点;
(3)盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗,导致![]() 浓度偏小,
浓度偏小,![]() 标准
标准![]() 偏大,据
偏大,据![]() 待测
待测 可知,
可知,![]() 待测
待测![]() 偏高;
偏高;
(4)注意参加反应的高锰酸钾与草酸的物质的量之比为2:5,![]() 待测
待测 ;
;
(5在![]() 溶液中,
溶液中,![]() ,说明
,说明![]() 的电离程度大于其水解程度,溶液显酸性。
的电离程度大于其水解程度,溶液显酸性。
A.据电荷守恒有![]() ,故A错误;
,故A错误;
B.据物料守恒有![]() ,故B正确;
,故B正确;
C.![]() ,说明
,说明![]() 的电离程度大于其水解程度,溶液显酸性,溶液显酸性,故C错误;
的电离程度大于其水解程度,溶液显酸性,溶液显酸性,故C错误;
D.据物料守恒有![]() ,故D正确;
,故D正确;
故答案为BD

【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g) ΔH1
C2H4(g)+C2H6(g) ΔH1
副反应:C4H10(g,正丁烷)![]() CH4(g)+C3H6(g) ΔH2 回答下列问题:
CH4(g)+C3H6(g) ΔH2 回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时的释放或吸收能量叫生成热,生成热可表示该物质相对能量。下表为25℃、101 kPa下几种有机物的生成热:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ·mol1 | 75 | 85 | 52 | 20 | 125 | 132 |
①表格中的物质,最稳定的是________________(填结构简式)。
②上述反应中,ΔH1=____________kJ·mol1。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。下列情况表明该反应达到平衡状态的是_________________(填代号)。
A.气体密度保持不变 B.![]() 保持不变
保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
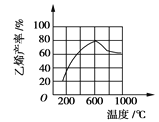
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,
随着温度升高,乙烯产率降低,可能的原因是____________(填代号)。
A.平衡常数降低 B.活化能降低
C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min 达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)为___________mol·L1·min1。
②上述条件下,正丁烷的平衡转化率为_____________;该反应的平衡常数K为____。
(5)丁烷空气燃料电池以熔融的K2CO3(其中不含O2和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e=6CO32-,负极反应式为____________________。