题目内容
3.稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17 种元素.稀土有“工业维生素”的美称,如今已成为极其重要的战略资源.几种稀土元素的电离能(单位:kJ•mol-1)
| 元素 | I1 | I2 | I3 | I1+I2+I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 4257 | 7019 |
| Y(钇) | 616 | 1181 | 1980 | 3777 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 3455 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3523 | 3547 |
(2)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2.
ICH2CH2I中碳原子杂化轨道类型为sp3,1mol CH2=CH2中含有的σ键数目为5NA.常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高.
(3)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点.则PrO2(二氧化镨)的晶胞中有8个氧原子.
(4)Ce(铈)单质为面心立方晶体,其胞参数为a=516pm.晶胞中Ce(铈)原子的配位数为12,列式表示Ce(铈)单质的密度:$\frac{4×140}{6.02×1{0}^{23}×({516×1{0}^{-10})}^{3}}$g•cm-3(不必计算出结果).
分析 (1)离子化合物 Na3[Sc(OH)6]中含有羟基与Sc的配位键,羟基中的氢氧元素之间的共价键.
(2)在ICH2CH2I分子中碳原子只形成了单键,有四个单键,故碳原子杂化轨道类型为sp3;1个CH2=CH2分子中含有5个σ键;晶体结构相似时,相对分子质量越大,熔沸点越高;
(3)CaF2晶胞如图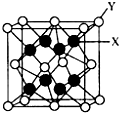 中,则图中Y为镨原子,X为氧原子,据此判断晶胞中氧原子数;
中,则图中Y为镨原子,X为氧原子,据此判断晶胞中氧原子数;
(4)Ce(铈)单质为面心立方晶体,以晶胞顶点的铈原子为例,与之距离最近的铈原子分布在经过该顶点的所有立方体的面心上,根据ρ=$\frac{m}{V}$可求得密度.
解答 解:(1)离子化合物 Na3[Sc(OH)6]中含有羟基与Sc的配位键,羟基中的氢氧元素之间的共价键,
故答案为:共价键和配位键;
(2)在ICH2CH2I分子中碳原子只形成了单键,有四个单键,故碳原子杂化轨道类型为sp3;1个CH2=CH2分子中含有5个σ键,故1mol CH2=CH2中含有的σ键数目为5NA,由于二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高,所以常温下1,2-二碘乙烷为液体而乙烷为气体,
故答案为:sp3;5NA;二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高;
(3)在晶胞 中,Y为镨原子,X为氧原子,可以看到氧原子在晶胞的内部,故此晶胞中应有8个氧原子,
中,Y为镨原子,X为氧原子,可以看到氧原子在晶胞的内部,故此晶胞中应有8个氧原子,
故答案为:8;
(4)Ce(铈)单质为面心立方晶体,以晶胞顶点的铈原子为例,与之距离最近的铈原子分布在经过该顶点的所有立方体的面心上,这样的面有12个,晶胞中铈原子位于顶点和面心,数目为8×1/8+6×1/2=4,该晶胞体积为a3,该晶胞的质量为4M/NA,根据ρ=$\frac{m}{V}$可知,密度为4M/NA×a3g•cm-3,即为$\frac{\frac{4×M}{{N}_{A}}}{{a}^{3}}$=$\frac{4×140}{6.02×1{0}^{23}×({516×1{0}^{-10})}^{3}}$g•cm-3,
故答案为:12;$\frac{4×140}{6.02×1{0}^{23}×({516×1{0}^{-10})}^{3}}$.
点评 本题主要考查了核外电子排布、电离能、化学键、晶胞的结构和晶胞的计算等知识,中等难度,答题时注意物质结构的基础知识的灵活运用.

 阅读快车系列答案
阅读快车系列答案| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 由于乳酸(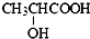 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 | |
| C. | 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物 | |
| D. | 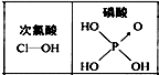 由如图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子 |
| A. | 使用高纯度的锌粒 | B. | 滴加几滴硫酸铜溶液 | ||
| C. | 使用浓H2SO4 | D. | 使用浓HNO3 |
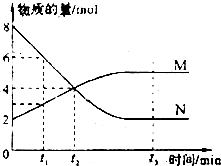 在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如下图,下 列表述中正确的是( )
在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如下图,下 列表述中正确的是( )| A. | t3时,正反应速率大于逆反应速率 | |
| B. | t2时,正逆反应速率相等,反应达到平衡状态I 已反应的 | |
| C. | 化学方程式为:2M=N | |
| D. | t1时,N的浓度是M浓度的2倍 |
| A. | 甲酸乙酯 | B. | 甲酸 | C. | 乙酸 | D. | 乙酸甲酯 |
| A. | 该反应体现了浓H2SO4的酸性和强氧化性 | |
| B. | 被还原的硫酸为$\frac{V}{22.4}$mol | |
| C. | 反应结束后两种反应物均有剩余 | |
| D. | 参加反应的铜为0.18mol |
①CaC2和MgC2都能跟水反应生成乙炔
②CaC2在水中以Ca2+和C22-形式存在
③C22-的电子式

④MgC2的熔点低,可能在100℃以下?
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 请认真观察如图,然后回答问题:
请认真观察如图,然后回答问题: