题目内容
15.将足量的铜片与20mL 18mol•L-1浓硫酸加热充分反应,收集到标准状况下的二氧化硫气体VL.下列对此反应的有关说法中错误的是( )| A. | 该反应体现了浓H2SO4的酸性和强氧化性 | |
| B. | 被还原的硫酸为$\frac{V}{22.4}$mol | |
| C. | 反应结束后两种反应物均有剩余 | |
| D. | 参加反应的铜为0.18mol |
分析 A.该反应的硫酸中部分S元素化合价不变、部分S元素化合价由+6价变为+4价;
B.被还原硫酸的物质的量与二氧化硫的物质的量相等,根据S元素守恒计算被还原硫酸的物质的量;
C.加热条件下,浓硫酸和Cu反应,但稀硫酸和Cu不反应;
D.根据二氧化硫和Cu之间的关系式计算.
解答 解:A.该反应的硫酸中部分S元素化合价不变、部分S元素化合价由+6价变为+4价,参加反应的浓硫酸化合价不变的部分体现酸性,化合价降低的部分体现强氧化性,故A正确;
B.被还原硫酸的物质的量与二氧化硫的物质的量相等,根据S元素守恒得被还原硫酸的物质的量=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,故B正确;
C.加热条件下,浓硫酸和Cu反应,但稀硫酸和Cu不反应,随着反应进行,浓硫酸变为稀硫酸时停止反应,所以反应结束后两种反应物均有剩余,故C正确;
D.发生的反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,因为浓硫酸变为稀硫酸时停止反应,硫酸有剩余,所以不能根据浓硫酸计算消耗Cu的量,可以根据二氧化硫计算Cu的消耗量,n(Cu)=n(SO2)=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,故D错误;
故选D.
点评 本题考查氧化还原反应有关计算,侧重考查学生分析计算能力,注意:浓硫酸和Cu在加热条件下反应而稀硫酸不反应,易错选项是D.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
5.在防止禽流感疫情时,防疫部门大量使用了含氯类消毒剂,其中氯胺是一种长效缓释的有机氯消毒剂,有强氧化性,其杀菌能力是一般含氯消毒剂的4-5倍,下列有关氯胺(NH2Cl)的说法中一定不正确的是( )
| A. | 氯胺水解产物最初为羟胺(NH2OH)和HCl | |
| B. | 氯胺在一定条件下可与乙烯加成得H2NCH2CH2Cl | |
| C. | 氯胺的消毒原理与漂白粉相似 | |
| D. | 氯胺的电子式为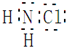 |
6.已知反应:X+Y=M+N 为放热反应,对该反应的下列说法中正确的是( )
| A. | X 的能量一定高于 M | |
| B. | X 和 Y 的总能量一定高于 M 和 N 的总能量 | |
| C. | Y 的能量一定高于 N | |
| D. | 因为该反应是放热反应,故不必加热反应就一定能发生 |
3.稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17 种元素.稀土有“工业维生素”的美称,如今已成为极其重要的战略资源.
几种稀土元素的电离能(单位:kJ•mol-1)
(1)离子化合物 Na3[Sc(OH)6]中,存在的作用力除离子键外还有共价键和配位键.
(2)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2.
ICH2CH2I中碳原子杂化轨道类型为sp3,1mol CH2=CH2中含有的σ键数目为5NA.常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高.
(3)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点.则PrO2(二氧化镨)的晶胞中有8个氧原子.
(4)Ce(铈)单质为面心立方晶体,其胞参数为a=516pm.晶胞中Ce(铈)原子的配位数为12,列式表示Ce(铈)单质的密度:$\frac{4×140}{6.02×1{0}^{23}×({516×1{0}^{-10})}^{3}}$g•cm-3(不必计算出结果).
几种稀土元素的电离能(单位:kJ•mol-1)
| 元素 | I1 | I2 | I3 | I1+I2+I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 4257 | 7019 |
| Y(钇) | 616 | 1181 | 1980 | 3777 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 3455 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3523 | 3547 |
(2)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2.
ICH2CH2I中碳原子杂化轨道类型为sp3,1mol CH2=CH2中含有的σ键数目为5NA.常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高.
(3)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点.则PrO2(二氧化镨)的晶胞中有8个氧原子.
(4)Ce(铈)单质为面心立方晶体,其胞参数为a=516pm.晶胞中Ce(铈)原子的配位数为12,列式表示Ce(铈)单质的密度:$\frac{4×140}{6.02×1{0}^{23}×({516×1{0}^{-10})}^{3}}$g•cm-3(不必计算出结果).
10.某有机物的结构简式为: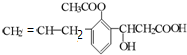 ,则此有机物可发生的反应类型有:①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦缩聚 ⑧中和 则( )
,则此有机物可发生的反应类型有:①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦缩聚 ⑧中和 则( )
 ,则此有机物可发生的反应类型有:①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦缩聚 ⑧中和 则( )
,则此有机物可发生的反应类型有:①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦缩聚 ⑧中和 则( )| A. | 除①⑥外均能 | B. | 除①⑦外均能 | C. | 除⑥⑦外均能 | D. | 以上反应均能 |
20.可以鉴别乙酸溶液、葡萄糖溶液、乙醇溶液的试剂是( )
| A. | NaOH溶液 | B. | 新制氢氧化铜悬浊液 | ||
| C. | 石蕊试液 | D. | 碳酸钠溶液 |
7.某卤代烃C5H11Cl发生消去反应时,可以得到两种烯烃,则该卤代烃的结构简式可能为( )
| A. | CH3-CH2-CH2-CH2-CH2Cl | B. |  | ||
| C. |  | D. | 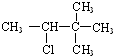 |
4.下列实验操作或记录正确的是( )
| A. | 常温常压下测得1molN2的质量为28g | |
| B. | 用量筒测得排水法收集制得的氢气体积为50.28mL | |
| C. | 用两只250mL的容量瓶配制0.1mol/L500mL的NaOH溶液 | |
| D. | 用托盘天平称得2.5g胆矾,受热充分失水后,固体质量减轻1.6g |
5.铁单质及其化合物在生活、生产中应用广泛.请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是Cu+2Fe3+=2Fe2++Cu2+.
(3)硫酸铁可作絮凝剂,常用于净水,其原理是Fe3++3H2O?Fe(OH)3+3H+(用离子方程式表示).在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是酸性环境中,氢离子抑制了铁离子的水解,无法生成氢氧化铁胶体.
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO═3Fe+4CO2,若有1.5mol Fe3O4参加反应,转移电子的物质的量是12mol.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是Cu+2Fe3+=2Fe2++Cu2+.
(3)硫酸铁可作絮凝剂,常用于净水,其原理是Fe3++3H2O?Fe(OH)3+3H+(用离子方程式表示).在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是酸性环境中,氢离子抑制了铁离子的水解,无法生成氢氧化铁胶体.
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO═3Fe+4CO2,若有1.5mol Fe3O4参加反应,转移电子的物质的量是12mol.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的 金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应 生成氢气 | 高温下氢气能还原氧化 铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁的表面能形 成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |