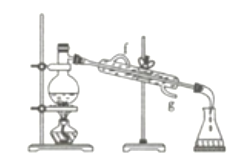
题目内容
【题目】如图实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为_____ mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。该学生需要量取___mL上述浓盐酸进行配制。
(4)①假设该同学成功配制 了0.400 mol/L的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取____ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是_____。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
【答案】11.9 B、D 16.8 25 C
【解析】
(1)根据物质的量浓度c=![]() 来计算;
来计算;
(2)根据该物理量是否与溶液的体积有关判断;
(3)设所需的浓盐酸的体积为VmL,根据溶液稀释定律c浓V浓=c稀V稀来计算;
(4)①根据n(HCl)=n(NaOH)计算;
②盐酸体积减少,说明标准液盐酸体积读数减小,逐项分析即可。
(1)盐酸溶液的物质的量浓度c=![]() =
=![]() mol/L=11.9;
mol/L=11.9;
(2)A.溶液中HCl的物质的量=cV,所以与溶液的体积有关,故A错误;
B.溶液的浓度c=![]() ,与溶液的体积无关,故B正确;
,与溶液的体积无关,故B正确;
C.溶液中Cl-的数目=nNA=cVNA,所以与溶液的体积有关,故C错误;
D.溶液的密度与溶液的体积无关,故D正确;
故选BD;
(3)设所需的浓盐酸的体积为VmL,根据溶液稀释定律c浓V浓=c稀V稀可知:11.9mol/L×VmL=0.4mol/L×500mL,解得V=16.8mL;
(4)①n(HCl)=n(NaOH)=0.4g÷40g/mol=0.01mol,V(HCl)=![]() =0.025L=25mL;
=0.025L=25mL;
②消耗的标准液盐酸体积减少,说明读数时标准液的体积比实际体积减少了,则
A.浓盐酸挥发,浓度不足,配制的标准液浓度减小,滴定时消耗盐酸体积变大,故A错误;
B.配制溶液时,未洗涤烧杯,标准液浓度减小,消耗体积增大,故B错误;
C.配制溶液时,俯视容量瓶刻度线,配制的标准液浓度变大,滴定时消耗的体积减小,故C正确;
D.加水时超过刻度线,用胶头滴管吸出,标准液浓度减小,滴定时消耗标准液体积增大,故D错误;
故答案为C。

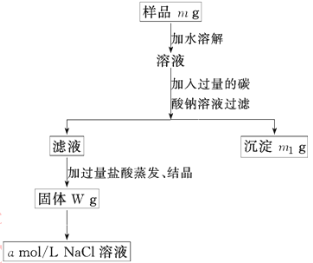
【题目】某同学用某种粗盐进行提纯实验,步骤见下图.

请回答:
(1)步骤①和②的操作名称是________.
(2)步骤③判断加入盐酸“适量”的方法是_____;
步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止___________,当蒸发皿中有较多量固体出现时,应___________,用余热使水分蒸干.
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含 CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | _____ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含 BaCO3 | 取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | ______ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,________ | _____ | 猜想Ⅲ成立 |
请写出猜想Ⅲ验证过程中发生的化学反应方程式_____