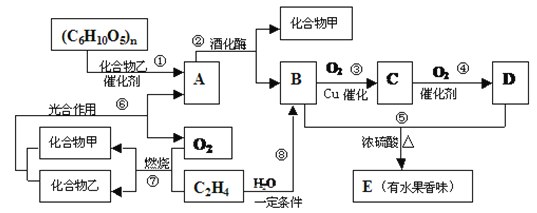
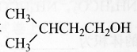题目内容
【题目】工业上可用甲烷和氧气按9:1的体积比混合,在200℃和10MPa的条件下,通过铜制管道反应制得甲醇:2CH4+O2=2CH3COH。
(1)已知一定条件下,CH4和CH3COH燃烧的热化学方程式分别为:
CH4(g)+SO2(g)=CO2(g)+2H2(g) △H=-802kJ/lmol
CH3OH(g)+l.5O2(g)=CO2(g)+2H2O(g) △H=-677kJ/mol
则2CH4(g)+O2(g)=2CH3OH(g) △H=__________
(2)甲烷固体氧化物燃料电池属于第三代燃料电池,是一种在中高温下直接将储存在燃料和氧化剂中的化学能高效、环境友好地转化成电能的全固态化学发电装置。其工作原理如下图所示。a是电池的____极(填“正”或“负”) ,b极的电极反应式为__________。

(3)工业上合成甲醇的另一种方法为:
CO(g)+2H2(g) ![]() CH3OH(g) △H=-90kJ/mol
CH3OH(g) △H=-90kJ/mol
T℃时,将2mol CO 和4molH2充入1L 的密闭容器中,测得H2的物质的量随时间变化如下图实线所示。
① 能用于判断反应已达化学平衡状态的是____________。
A.气体的总压强不再改变
B. H2与CH3OH的体积比不再改变
C.气体的密度不再改变
D.单位时间内消耗1mol CO,同时生成1mol CH3OH
② 请计算出T℃ 时反应的平衡常数K=_________________。
③ 仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅰ对应的实验条件改变是:________;曲线Ⅱ对应的实验条件改变是_________0。

④ a、b、c三点逆反应速率由大到小排列的顺序是__________。
【答案】 -250KJ/mol 正 CH4+4O2-8e-=CO2+2H2O AB 3(mol/L)2 升高温度 增大压强(或增大CO的浓度) b>c>a
【解析】试题分析:(1)根据盖斯定律计算反应热;(2)根据![]() 移动方向,可知a是正极,b是负极;(3)根据平衡状态的直接判据和间接判据判断平衡状态;利用三段式计算平衡常数;曲线Ⅰ反应速率加快、氢气的物质的量增大;曲线Ⅱ反应速率加快、氢气的物质的量减小;
移动方向,可知a是正极,b是负极;(3)根据平衡状态的直接判据和间接判据判断平衡状态;利用三段式计算平衡常数;曲线Ⅰ反应速率加快、氢气的物质的量增大;曲线Ⅱ反应速率加快、氢气的物质的量减小;
解析:(1)
CH4(g)+SO2(g)=CO2(g)+2H2(g) △H=-802KJ/lmol
②CH3COH(g)+l.5O2(g)=CO2(g)+2H2O(g) △H=-677kJ/mol
根据盖斯定律,2×①-2×②得2CH4(g)+O2(g)=2CH3OH(g) △H= -250KJ/mol;(2)根据![]() 移动方向,可知a是正极,b是负极,负极甲烷失电子生成二氧化碳和水,负极反应式为CH4+4O2--8e-=CO2+2H2O;
移动方向,可知a是正极,b是负极,负极甲烷失电子生成二氧化碳和水,负极反应式为CH4+4O2--8e-=CO2+2H2O;
(3)①CO(g)+2H2(g) ![]() CH3OH(g) 反应,气体系数和不同;
CH3OH(g) 反应,气体系数和不同;
A.气体物质的量是变量,所以气体的总压强不再改变,一定平衡;
B. 氢气是反应物、甲醇是生成物,H2与CH3OH的体积比不再改变,一定平衡;
C.根据![]() ,气体质量不变、容器体积不变,所以密度是常量,气体的密度不再改变,不一定平衡;
,气体质量不变、容器体积不变,所以密度是常量,气体的密度不再改变,不一定平衡;
D.消耗CO,生成CH3OH都是正反应方向,故D不一定平衡;
② 根据图像可知
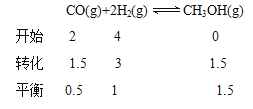
![]() 3;
3;
曲线Ⅰ反应速率加快、氢气的物质的量增大,说明平衡逆向移动,所以改变条件是升高温度;曲线Ⅱ反应速率加快、氢气的物质的量减小,说明平衡正向移动,所以改变条件是增大压强;④b点温度高于c点,所以平衡时逆反应速率b>c,a点、c点温度相同,但c点甲醇浓度大于a,所以逆反应速率c>a,a、b、c三点逆反应速率由大到小排列的顺序是b>c>a。

【题目】中国的锰矿石和锌矿石产地在云南、广东、青海等。软锰矿是一种常见的锰矿石,其主要成分是MnO2,含少量Al2O3和SiO2。闪锌矿主要成分是ZnS,含少量FeS、CuS、CdS等杂质,晶体属于六方晶系。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下。

已知:Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中MnO2、CuS与硫酸共热时有淡黄色物质析出,请写出该反应的化学方程
式___________________。
(2)步骤②加入适量金属锌是为了回收金属,回收金属的主要成分是_________________。
(3)步骤③中MnO2的作用是________________,另外一种物质X可以是__________。
A.ZnO B.MgO C.Cu2(OH)2CO3 D.MnCO3
(4)锂离子电池的正极材料有多种,其中MnO2与Li构成LiMnO2是一种常见的正极材料。电池反应方程式为:Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式_____________________。
已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,
向NaCN溶液中通入少量的H2S气体,反应的离子方程式为_______________________。
在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L-1 Mn2+废水
中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10―4 mol·L-1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×10-15]
【题目】除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是( )
混合物 | 试剂 | 分离方法 | |
A | 苯(苯酚) | 溴水 | 过滤 |
B | 乙烷(乙烯) | 氢气 | 加热 |
C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
D | 溴苯(溴) | NaOH溶液 | 分液 |
A. AB. BC. CD. D