题目内容
18.下列说法中正确的是( )| A. | 原电池放电过程中,负极质量一定减轻,正极质量一定增加 | |
| B. | 常温下浓硫酸与铝不反应,所以常温下可用铝制贮罐贮运浓硫酸 | |
| C. | 8NH3(g)+6NO2(g)=7N2(g)+12 H2O(g)△H<0该反应一定能自发进行 | |
| D. | 提取海带中的碘元素时,为将I-完全氧化为I2,用HNO3作氧化剂比用H2O2效果好 |
分析 A、燃料电池形成的原电池放电过程中,正负极质量不变;
B、常温下浓硫酸能使铝发生钝化;
C、根据反应是否自发进行的判据:△H-T△S<0来判断;
D、HNO3、H2O2都能将I-完全氧化为I2,效果相同.
解答 解:A、燃料电池形成的原电池放电过程中,两个电极上都是通入的气体发生的氧化还原反应,正负极质量不变,故A错误;
B、常温下浓硫酸能使铝发生钝化,不是不反应,故B错误;
C、反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行,已知8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,反应后气体物质的量增大,则△S>0,所以△H-T△S<0,反应自发进行,故C正确;
D、HNO3、H2O2都能将I-完全氧化为I2,效果相同,但是H2O2做氧化剂产物为水,无污染,所以应该用H2O2作氧化剂,故D错误;
故选C.
点评 本题考查了反应自发性的判断、氧化剂的选择、原电池原理、Ksp的应用,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.一定条件下的反应:PCl5(g)?PCl3(g)+Cl2(g)(正反应吸热)达到平衡后,下列情况使PCl5分解率降低的是 ( )
| A. | 温度、体积不变,充入氩气 | B. | 条件不变,对体系加热 | ||
| C. | 温度、体积不变,充入氯气 | D. | 温度不变,增大容器体积 |
9.已知:在25℃时,向10mL 0.01mol•L-1NaCN溶液中逐滴加入0.01mol•L-1的盐酸,滴定曲线如图1所示,CN-、HCN浓度所占分数(α)随pH变化的关系如图2所示,下列表述正确的是( )
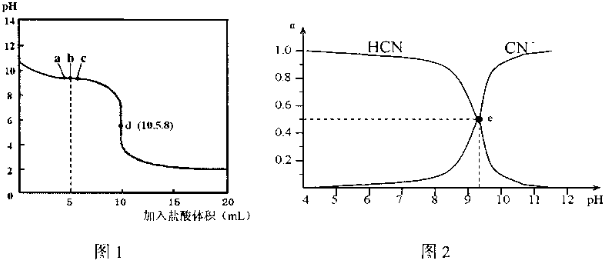

| A. | b点时,溶液中微粒浓度大小的关系:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+) | |
| B. | d点溶液存在的关系:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-) | |
| C. | 图2中的e点对应图1中的c点 | |
| D. | 在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小 |
6.下列物质中同分异构体数目最多的是( )
| A. | C2H6O | B. | C3H8O | C. | C3H6BrCl | D. | C4H9Cl |
13.下列说法正确的是( )
| A. | 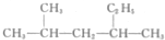 的名称为2-甲基-4-乙基戊烷 的名称为2-甲基-4-乙基戊烷 | |
| B. |  互为同分异构体 互为同分异构体 | |
| C. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
3.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1mol Na2O和Na2O2的混合物中,阴阳离子总数为3NA | |
| B. | 非标准状况下,NA个CO2分子所占的条件不可能为22.4L | |
| C. | 24.4gNa2O•SiO2中含有0.2NA个SiO2分子 | |
| D. | 56gFe投入1000mL3.5mol•L-1稀硝酸中,充分反应,转移电子总数为3NA |
10. 苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )
苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )
 苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )
苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )| A. | 苯甲酸叶醇酯能发生氧化反应 | |
| B. | 苯甲本叶醇酯能使溴的四氯化碳溶液褪色 | |
| C. | 1mol苯甲酸叶醇酯最多能与4molH2发生加成反应 | |
| D. | 1mol苯甲酸叶醇酯与NaOH溶液反应时,能消耗2molNaOH |
7.氮和硅均是自然界含量非常丰富的元素.
(1)氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
(2)向大气中排放NOx可能导致的环境问题有酸雨、光化学烟雾、臭氧层破坏(任一点均可).(任答一点)用足量NaOH溶液能完全吸收NO2生成NaNO2、NaNO3和H2O2.试写出该反应的离子方程式:2NO2+2OH-═NO3-+NO2-+H2.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种技术路线,其中一种工艺流程如图1:
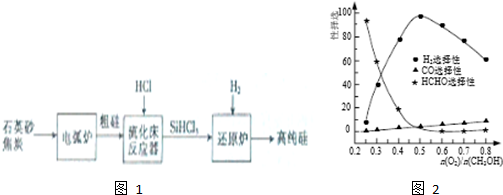
①电弧炉中发生的主要反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
(4)“硅能源”有望成为二十一世纪的新能源.1mol硅完全燃烧能放出910kJ的热量,写出该反应的热化学方程式:Si(S)+O2(g)═SiO2(S)△H=-910KJ/mol;与“氢能源”比较“硅能源”具有的优点是产物不污染环境,储存、运输方便.
(5)工业上常利用甲醇部分氧化法制备氢气.在一定温度下以Ag/CeO2-SiO2为催化剂时原料气比例对反应选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示.则当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$=0.25时,CH3OH与O2发生的主要反应方程式为2CH3OH+O2$→_{△}^{催化剂}$2HCHO+2H2O;当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$>0.5时,H2选择性下降的原因氧气过量,与氢气反应生成水.
(1)氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
(2)向大气中排放NOx可能导致的环境问题有酸雨、光化学烟雾、臭氧层破坏(任一点均可).(任答一点)用足量NaOH溶液能完全吸收NO2生成NaNO2、NaNO3和H2O2.试写出该反应的离子方程式:2NO2+2OH-═NO3-+NO2-+H2.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种技术路线,其中一种工艺流程如图1:

①电弧炉中发生的主要反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(5)工业上常利用甲醇部分氧化法制备氢气.在一定温度下以Ag/CeO2-SiO2为催化剂时原料气比例对反应选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示.则当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$=0.25时,CH3OH与O2发生的主要反应方程式为2CH3OH+O2$→_{△}^{催化剂}$2HCHO+2H2O;当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$>0.5时,H2选择性下降的原因氧气过量,与氢气反应生成水.
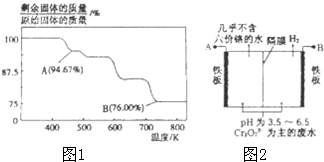 CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.
CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.