题目内容
【题目】【物质结构与性质】
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 [Cu(NH3)4]SO4·H2O。
(1)Cu基态核外电子排布式为 。
[Cu(NH3)4]SO4·H2O中,与Cu2+形成配位键的原子是 (填元素符号)。
(2)乙醇分子中碳原子轨道杂化类型为 。
与H2O互为等电子体的一种阴离子为 (填化学式)。
(3)[Cu(NH3)4]SO4·H2O含有 。(填序号)
a.离子键 b.极性共价键 c.非极性共价键 d.金属键 e.氢键
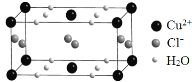
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是 。
【答案】
(1)1s22s22p63s23p63d104s1(2分);N(2分)
(2)sp3(2分);NH2—(2分)
(3)abe(2分)
(4)CuCl2·2H2O(2分)
【解析】
试题分析:
(1)铜是29号元素,Cu基态核外电子排布式为1s22s22p63s23p63d104s1;[Cu(NH3)4]SO4·H2O中,与Cu2+形成配位键的配位体是NH3,NH3中N原子含有孤电子对,与Cu2+形成配位键的原子是N,故答案为:1s22s22p63s23p63d10;N;
(2)乙醇分子中两个碳原子均形成4个单键,所以轨道杂化类型为sp3;与H2O互为等电子体阴离子有NH2—、OH—等;
(3)[Cu(NH3)4]SO4·H2O中内界与外界形成离子键,水分子和氨气分子含有极性共价键,水分子和配合物形成氢键等;
(4)晶胞中Cu2+的个数为8×![]() +2×
+2×![]() =2,Cl-的个数为4×
=2,Cl-的个数为4×![]() +2=4,H2O的个数为8×
+2=4,H2O的个数为8×![]() +4×
+4×![]() =4,故三种微粒的数目比为:2:4:4=1:2:2,该化合物的化学式为CuCl2·2H2O,故答案为:CuCl2·2H2O;
=4,故三种微粒的数目比为:2:4:4=1:2:2,该化合物的化学式为CuCl2·2H2O,故答案为:CuCl2·2H2O;

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】a、b、c、d、e五种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的气态氢化物分子中有3个共价键。试推断:
(1)写出b元素在周期表中的位置 ;
(2)写出一种由a、c、d所形成的离子化合物 (化学式),它与e的最高价氧化物对应水化物的溶液加热时反应的离子方程式是 ;
(3)c的单质的电子式为 。
(4)b的最简单气态氢化物的结构式是
(5)b和d相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (选填字母序号)。
A.常温下,b的单质呈固态,d的单质呈气态 |
B.d的氢化物的稳定性强于b的氢化物 |
C.b与d形成的化合物中,b呈正价 |
D.d的氢化物的沸点高于b的氢化物 |