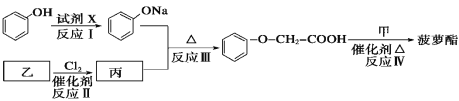
题目内容
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C+和B3-具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的原子个数为1:1的化合物,是人们生活的必需品。回答下列问题:
(1)五种元素中,原子半径最大的是______,非金属性最强的是______(填元素符号)。
(2)由A和D、E所形成的共价型化合物中,热稳定性差的是________(用化学式表示)。
(3)A和E形成的化合物与A和B形成的化合物反应,所得产物中存在的化学键类型为_______。用电子式表示A和B其形成化合物过程________________________________________。
(4)D最高价氧化物的水化物的化学式为____________。
(5)将单质E通入氯化亚铁溶液时,反应的离子方程式为________________。
【答案】(1)Na;Cl (2)PH3(3)离子键和共价键![]()
(4)H3PO4(或 HPO3) (5)2Fe2++Cl2==2Fe3++2Cl-
【解析】试题分析:五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C+和B3-具有相同的电子层结构,则C为Na、B为N元素,D为P元素;A和B、D、E均能形成共价型化合物,A和B形成的化合物在水中呈碱性,则A为H元素;C和E形成的原子个数为1:1的化合物,是人们生活的必需品,则E是Cl元素。
(1)同周期自左向右原子半径逐渐减小,元素非金属性随着原子序数增大而增强,同一主族元素,自上而下原子半径逐渐增大,元素非金属性随着原子序数增大而减弱,这几种元素中非金属性最强的是Cl元素,原子半径最多的是Na;
(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性P<Cl,所以氢化物的热稳定性较差的是PH3;
(3)A和E形成的化合物是氯化氢,A和B形成的化合物是氨气,二者反应生成氯化铵,其化学式为NH4Cl;铵根离子和酸根离子之间存在离子键、N-H原子之间存在共价键;氨气是含有共价键的共价化合物,其形成过程可表示为![]() 。
。
(4)D为P元素,其最高价氧化物的水化物是磷酸,化学式为H3PO4;
(5)E的单质是氯气,为黄绿色气体,氯气具有强氧化性,能氧化亚铁离子生成铁离子而导致溶液变为黄色,离子方程式为2Fe2++Cl2==2Fe3++2Cl-。

 小学教材全测系列答案
小学教材全测系列答案