题目内容
【题目】CH4和CO2可以制造价值更高的化学产品。
已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-802.0 kJ·mol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH3=-566.0 kJ·mol-1
(1)求反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH=________ kJ·mol-1(用含a、b、c的代数式表示)。
2CO(g)+2H2(g) ΔH=________ kJ·mol-1(用含a、b、c的代数式表示)。
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为_____________________。
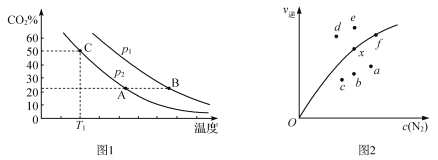
(3)用Cu2Al2O4作催化剂,一定条件下发生反应:CO2(g)+CH4(g)![]() CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
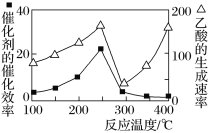
①250~300 ℃时,乙酸的生成速率降低的原因是________________________________。
②300~400 ℃时,乙酸的生成速率升高的原因是________________________________。
(4)已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)。在850℃时,K=1。此温度下,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和xmol H2,则:
CO2(g)+H2(g)。在850℃时,K=1。此温度下,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和xmol H2,则:
①当x=5.0时,上述反应向______方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是______。
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a______b(填“大于”“小于”或“等于”)。
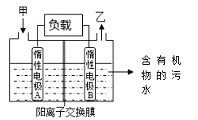
(5)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组用甲烷燃料电池进行饱和氯化钠溶液电解实验,如图所示:
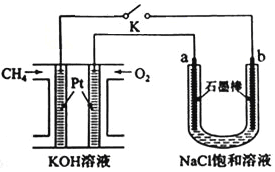
回答下列问题:
若电池甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的电量为_______ (已知NA=6.02×1023mol-1,电子电荷量为1.60×10-19C,列式表示即可),最多能产生的氯气体积 为_______L(标准状况)。
【答案】
(1)-949.0(2分)
(2)3CO+3H2==CH3OCH3+CO2(2分)
(3)①催化剂的催化效率降低,化学反应速率降低(1分)
②温度升高,化学反应速率加快(1分)
(4)①逆反应(1分)
②0≤x<3(2分)
③小于(1分)
(5)3.44×104C(2分) 4(2分)
【解析】
试题分析:
(1)用第一个+第二个×2-第三个×2得:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
ΔH=(-802.0-412×2+556×2) kJ·mol-1=-949.0 kJ·mol-1
(2)参与大气循环的无机化合物气体只能是CO2,所以方程式为3CO+3H2===CH3OCH3+CO2。
(3)①250~300 ℃时,乙酸的生成速率降低的原因是催化剂的催化效率降低,化学反应速率降低;②300~400 ℃时,乙酸的生成速率升高的原因是温度升高,化学反应速率加快。
(4)①此时的浓度商Qc==1.67,大于平衡常数1,故平衡向逆反应方向移动;
②平衡向正反应方向移动,浓度商小于平衡常数,即<1,解得x<3,所以0≤x<3;
③加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生成物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H2的体积分数:a%<b%;
(5)因为CH4-8e-+10OH-=CO32-+7H2O,所以电池甲烷通入量为1L(标准状况),通过电解池的电量为×8×6.02×1023mol-1×1.60×10-19C=3.44×104C;根据电子得失守恒可知,氯气的体积是×8÷2×22.4L/mol=4L。