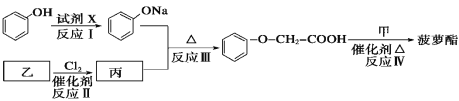
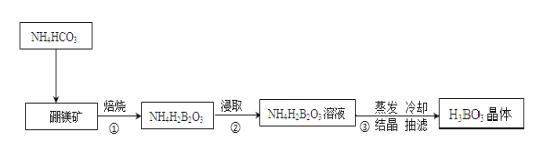
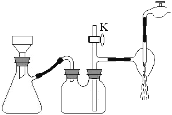
题目内容
【题目】[化学——选修2:化学与技术]辉铜矿主要成分为Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质。研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜。主要工艺流程如下:
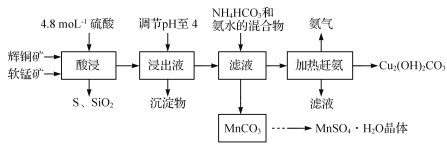
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
④MnSO4·H2O溶于1份冷水、0.6份沸水,不溶于乙醇。
(1)实验室配制250 mL 4.8 mol·L1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要 。
(2)酸浸时,为了提高浸取率可采取的措施有 (任写一点)。得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式: 。
(3)调节浸出液pH=4的作用是 。
(4)本工艺中可循环使用的物质是 (写化学式)。
(5)获得的MnSO4·H2O晶体需要进一步洗涤、干燥,洗涤时应用 洗涤。
(6)测定MnSO4·H2O样品的纯度:准确称取样品14.00 g,加蒸馏水配成100 mL溶液,从中取出25.00 mL用标准的BaCl2溶液测定,完全反应后得到了4.66 g沉淀,则此样品的纯度为__________(保留三位有效数字)。
【答案】(1)250 mL容量瓶、胶头滴管(2分)
(2)粉碎矿石(或加热或者搅拌)(任写一点)(1分) Cu2S+2MnO2+4H2SO4![]() 2CuSO4+2MnSO4+S↓+ 4H2O(3分)
2CuSO4+2MnSO4+S↓+ 4H2O(3分)
(3)使Fe3+完全水解生成氢氧化铁沉淀,而 Cu2+、Mn2+不形成沉淀(2分)
(4)NH3(2分)
(5)酒精(2分)
(6)96.6%(3分)
【解析】(1)配制一定物质的量浓度的溶液,必不可少的玻璃仪器是容量瓶和胶头滴管,容量瓶要标明规格,本题必须使用250 mL容量瓶。
(2)酸浸时矿石颗粒大小影响浸取率,可以通过粉碎矿石提高浸取率,还可以适当升高温度或者搅拌提高浸取率。根据信息,MnO2能将金属硫化物中的硫氧化为单质硫,反应物是Cu2S、MnO2、H2SO4,生成物是CuSO4、MnSO4、S,把硫化亚铜看成整体,化合价变化是:(1×2+2×1)=4,Mn元素化合价变化是:42=2,所以二氧化锰化学计量数是2,硫化亚铜的是1,再根据观察法配平其它物质,反应的化学方程式是:Cu2S+2MnO2+4H2SO4![]() 2CuSO4+2MnSO4+S↓+4H2O。
2CuSO4+2MnSO4+S↓+4H2O。
(3)根据金属阳离子生成氢氧化物沉淀的pH范围,使Fe3+完全沉淀且Cu2+、Mn2+不沉淀的pH范围是:3.2~4.4,故选择pH=4目的是使Fe3+完全水解生成氢氧化铁沉淀,而 Cu2+、Mn2+不形成沉淀。
(4)工艺流程中,加入了氨水,最后又得到了氨气,因此NH3 可循环使用。
(5)硫酸锰晶体不溶于酒精,故获得的MnSO4·H2O晶体后常用酒精洗涤,目的是减少MnSO4H2O晶体的损失。
(6)根据提示n(BaSO4)=n(SO42)=n(MnSO4·H2O)=![]() =0.02 mol,25 mL溶液中含有n(SO42)= n(MnSO4·H2O)=0.02 mol,则100 mL溶液含有n(MnSO4·H2O)=0.08 mol,m(MnSO4·H2O)=0.08×169=13.52(g),那么样品的纯度为
=0.02 mol,25 mL溶液中含有n(SO42)= n(MnSO4·H2O)=0.02 mol,则100 mL溶液含有n(MnSO4·H2O)=0.08 mol,m(MnSO4·H2O)=0.08×169=13.52(g),那么样品的纯度为![]() =96.6%。
=96.6%。

 名校课堂系列答案
名校课堂系列答案