题目内容
【题目】元素周期表中前两周期的六种元素X、Y、Z、M、N、Q原子序数依次增大,六种元素价电子数之和为26,原子半径依Y、Z、M、N、Q、X依次减小。依据信息,回答下列问题:
(1)Q的核外电子排布图为 。
(2)除X外,其余元素的第一电离能由小到大的顺序为 (用元素符号作答)。
(3)固体A是由以上六种元素中的某些元素组成的离子晶体,结构类似于CsCl,组成中含M元素的质量分数为73.7%,A所有原子的最外层都满足稀有气体原子结构,A受热分解可生成两种单质气体。写出A的电子式 ,常温下A与水反应的化学方程式为 。
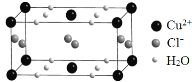
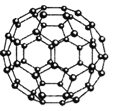
(4)Z元素形成的另一种分子晶体结构如图所示,Z60分子是由60个Z原子构成的,形状酷似足球,有32个面,其中12个面为正五边形,20个面为正六形。Z60分子可与Q元素形成的单质Q2发生加成反应,则加成产物的化学式为 。
【答案】(1)![]() (2)B<C<O<N<F(3)
(2)B<C<O<N<F(3)![]() NH4H+H2O=NH3·H2O+H2↑(4)C60F60
NH4H+H2O=NH3·H2O+H2↑(4)C60F60
【解析】试题分析:元素周期表中前两周期的六种元素X、Y、Z、M、N、Q原子序数依次增大,原子半径依Y、Z、M、N、Q、X依次减小,X是H元素;六种元素价电子数之和为26,所以Y是B元素、Z是C元素、M是N元素、N是O元素、Q是F元素。
(1)F元素的核外电子排布图为![]() 。
。
(2)同周期元素第一电离能从左到右逐渐增大,由于N元素2P轨道处于半充满状态,第一电离能大于O,所以B、C、N、O、F,第一电离能由小到大的顺序为B<C<O<N<F。
(3)固体A是由以上六种元素中的某些元素组成的离子晶体,结构类似于CsCl,组成中含N元素的质量分数为73.7%,A所有原子的最外层都满足稀有气体原子结构,A受热分解可生成两种单质气体,A是NH4H。NH4H的电子式![]() ,常温下NH4H与水反应生成氢气和氨水的化学方程式为NH4H+H2O=NH3·H2O+H2↑。
,常温下NH4H与水反应生成氢气和氨水的化学方程式为NH4H+H2O=NH3·H2O+H2↑。
(4)每个C原子形成4个共价键,60个C原子的共价键总数是4×60÷2=120; C60分子有32个面,其中12个面为正五边形,20个面为正六形,边数=(12×5+20×6) ÷2=90,C60分子共有120-90=30个双键。1个C60分子可与30个F 2分子发生加成反应,则加成产物的化学式为C60F60。