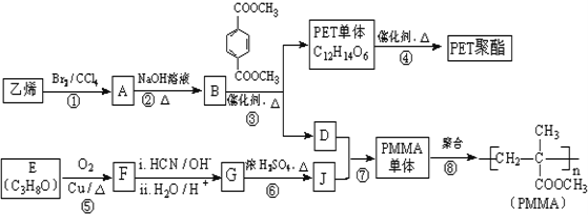
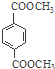
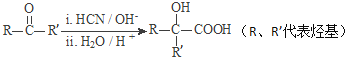题目内容
【题目】达比加群酯,是由德国公司开发的新型口服抗凝血药物,针对急性和慢性血栓栓塞性疾病的预防及治疗。F是其合成过程中的重要中间体,以下是F的合成路线图:(-Me表示甲基)

(1)写出A中含氧官能团的名称:_________和__________。
(2)B→C的反应类型是______________________。
(3)写出C→D转化的化学方程式__________________________。
(4)写出符合条件的B的同分异构体的结构简式_________________。
①属于芳香族化合物 ②能发生银镜反应 ③分子中只有两种化学环境不同的氢原子
(5)已知:![]()
肉桂酰氯![]() 是一种重要的合成中间体,试写出以苯甲醇和乙醛为原料合成该化合物的合成路线流程图(无机原料任用)。
是一种重要的合成中间体,试写出以苯甲醇和乙醛为原料合成该化合物的合成路线流程图(无机原料任用)。
合成路线流程图示例如下:
![]()
【答案】
(1)羧基、硝基(2分)
(2)取代反应(2分)
(3) + CH3NH2
+ CH3NH2![]()
 + HCl(3分)
+ HCl(3分)
(4)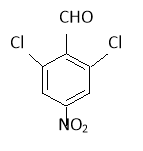 (3分)
(3分)
(5)
 (5分)
(5分)
【解析】
试题分析:
(1)A中的含氧官能团为羧基和硝基;
(2)观察B、C的结构简式判断为取代反应;
(3)C→D反应为取代反应,是苯环上的氯原子取代氨基中的氢原子,得到HCl和D;
(4)根据信息确定物质中含有苯环、醛基,剩余的只能是硝基和两个氯原子,根据对称性排列得到符合要求的结构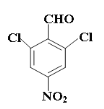 或
或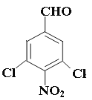 ;
;
(5)根据碳原子数确定目标产物是两种原料苯甲醇和乙醛结合的产物,再根据提供的信息,两种醛可以结合,所以先把苯甲醇氧化为苯甲醛,产物再由醛到酸,最后形成酰氯,流程见答案。

练习册系列答案
相关题目