题目内容
1.用铝热法从下列金属氧化物中制取相应的金属各1mol,消耗铝的质量最多的是( )| A. | Fe2O3 | B. | V2O5 | C. | MnO2 | D. | Cr2O3 |
分析 根据化合价的变化判断,化合价变化的数值越大,说明发生氧化还原反应时得到的电子数目越多,则消耗铝的量越多.
解答 解:A.Fe2O3中Fe的化合价为+3,
B.V2O5中V的化合价为+5,
C.MnO2中Mn的化合价为+4,
D.Cr2O3中Cr的化合价为+3,
V元素化合价变化最多,根据电子转移守恒,故生成1molV时,消耗Al最多,
故选B.
点评 本题考查氧化还原反应的计算,注意从化合价变化的角度判断,题目难度不大.

(1)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)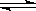 CH3OH(g)+H2O(g)△H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g)△H1=-49.1kJ·mol-1
2CH3OH(g)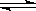 CH3OCH3
CH3OCH3 (g)+H2O(g)△H2=-24.5kJ·mol-1
(g)+H2O(g)△H2=-24.5kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式  。
。
(2)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
①已知反应2HI(g)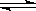 H2(g) + I2(g)的△H= + 11kJ•mol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、1
H2(g) + I2(g)的△H= + 11kJ•mol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、1 51KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_________kJ。
51KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_________kJ。
②Bodensteins研究了下列反应:2HI(g)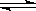 H2(g)+I2(g)
H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
X(HI) | 0 | 0.60 | 0.73 |
| 0.780 | 0.784 |
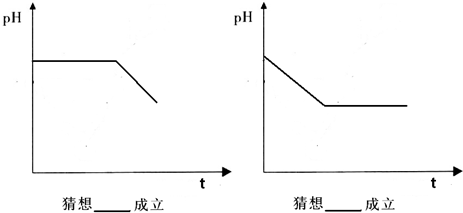
根据上述实验结果,该反应的平衡常数K的计算式为: 。上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2 ),其中k正、k逆为速率常数,则k
),其中k正、k逆为速率常数,则k 逆为 (以K和k正表示)。若k正=0.0027min﹣1,在t=40min时,v正= min﹣1。
逆为 (以K和k正表示)。若k正=0.0027min﹣1,在t=40min时,v正= min﹣1。
| A. | 苯、溴苯、四氯化碳 | B. | 苯、乙醇、四氯化碳 | ||
| C. | 硝基苯、乙醇、四氯化碳 | D. | 硝基苯、乙醇、乙酸 |
| A. | 乙烯、苯、乙酸分子中的所有原子都在同一平面上 | |
| B. | 蛋白质、淀粉、纤维素和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 |
| A. | C2H4O | B. | C2H6O | C. | C3H4O2 | D. | C3H6O2 |
| A. | 在炭粉燃烧中加入KClO3 | |
| B. | Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸 | |
| C. | 在K2S04与BaCl2两溶液反应时,增大压强 | |
| D. | Na与乙醇反应时增大乙醇的用量 |
 0.773
0.773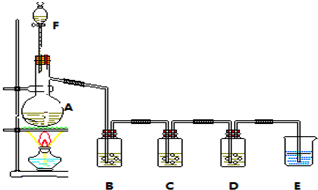

 (其中R为烃基),实验室由以下方法可得到DMP:
(其中R为烃基),实验室由以下方法可得到DMP: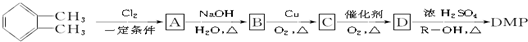
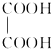 )在一定条件下可以按物质的量1:1发生反应生成高分子化合物,该高分子化合物的结构简式为
)在一定条件下可以按物质的量1:1发生反应生成高分子化合物,该高分子化合物的结构简式为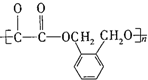 .
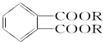
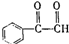
.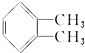 )为原料先生产苯酐(
)为原料先生产苯酐(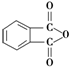 ),再使其与某醇在一定条件下反应制取DMP.苯酐与该醇制取DMP的化学方程式为
),再使其与某醇在一定条件下反应制取DMP.苯酐与该醇制取DMP的化学方程式为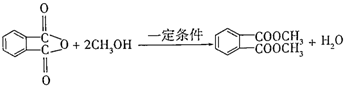 .
. .B也存在多种同分异构体,符合下列条件的B同分异构体有6种.
.B也存在多种同分异构体,符合下列条件的B同分异构体有6种.