题目内容
18.同体积的1mol/L的HCl、H2SO4、CH3COOH分别加入过量的Mg.下列叙述中正确的是( )| A. | HCl、H2SO4中放出H2的速率相同 | |
| B. | CH3COOH中放出H2的速率最快 | |
| C. | H2SO4中放出H2的速率最快,CH3COOH中放出H2的速率最慢 | |
| D. | H2SO4中放出H2的量最多,其余的相等 |
分析 稀盐酸、稀硫酸和醋酸与镁反应都生成氢气,醋酸是弱酸在溶液中部分电离,其氢离子的浓度小于酸的浓度;HCl在溶液中完全电离,其氢离子的浓度等酸的浓度,H2SO4在溶液中完全电离,其氢离子的浓度等于酸的浓度的2倍,
A.放出氢气的速率与氢离子浓度的定性有关;
B.等浓度的三种溶液中,醋酸为弱酸,氢离子浓度最小,放出氢气的速率最小;
C.硫酸溶液中氢离子浓度最大,放出氢气速率最大,醋酸中氢离子浓度最小,放出氢气速率最小;
D.硫酸为二元酸,其氢离子的物质的量最大,盐酸和醋酸都是一元酸,二者能够提供的H的物质的量相等.
解答 解:A.等浓度的盐酸和硫酸溶液中,硫酸溶液中的氢离子浓度大于盐酸,则硫酸放出氢气的速率大,故A错误;
B.醋酸为弱酸,在溶液中只能部分电离出氢离子,则等浓度的三种溶液中,醋酸氢离子浓度最小,放出氢气速率最小,故B错误;
C.硫酸溶液中氢离子浓度最大,与镁反应放出氢气速率最大,醋酸溶液中氢离子浓度最小,与镁反应放出氢气速率最小,故C正确;
D.镁过量,硫酸为二元酸,则其氢离子的浓度等于酸的浓度的2倍,所以硫酸放出的氢气最多,醋酸和盐酸都是一元酸,二者放出氢气的量相等,故D正确;
故选CD.
点评 本题考查了酸和金属的反应、弱电解质的电离,题目难度中等,明确影响酸和足量金属反应生成氢气速率、氢气的量的因素即可解答,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
6.下列叙述正确的是( )
| A. | 乙烯、苯、乙酸分子中的所有原子都在同一平面上 | |
| B. | 蛋白质、淀粉、纤维素和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 |
13.燃烧等物质的量有机物A和乙醇,消耗等量的氧气.此时乙醇反应后生成的H2O是A的1.5倍,而有机物A反应后生成的CO2是乙醇的1.5倍.则有机物A的分子式为( )
| A. | C2H4O | B. | C2H6O | C. | C3H4O2 | D. | C3H6O2 |
3.下列关于有机化合物的说法正确的是( )
| A. | 可用酸性KMnO4溶液除去乙烷中的乙烯 | |
| B. | 乙烷和乙烯都能使酸性KMnO4溶液褪色 | |
| C. | 淀粉、油脂、蔗糖在一定条件下都能发生水解 | |
| D. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 |
4.a mol O2气体和a mol O3气体相比较,下列叙述一定正确的是( )
| A. | 体积相同 | B. | 质量相等 | C. | 分子数相等 | D. | 原子数相等 |

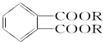 (其中R为烃基),实验室由以下方法可得到DMP:
(其中R为烃基),实验室由以下方法可得到DMP: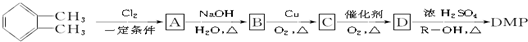
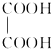 )在一定条件下可以按物质的量1:1发生反应生成高分子化合物,该高分子化合物的结构简式为
)在一定条件下可以按物质的量1:1发生反应生成高分子化合物,该高分子化合物的结构简式为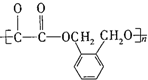 .
.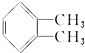 )为原料先生产苯酐(
)为原料先生产苯酐(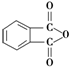 ),再使其与某醇在一定条件下反应制取DMP.苯酐与该醇制取DMP的化学方程式为
),再使其与某醇在一定条件下反应制取DMP.苯酐与该醇制取DMP的化学方程式为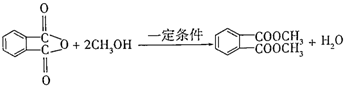 .
.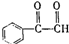 .B也存在多种同分异构体,符合下列条件的B同分异构体有6种.
.B也存在多种同分异构体,符合下列条件的B同分异构体有6种.