题目内容
8.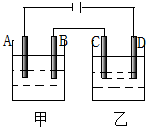 按图装置进行电解实验(A、B、C、D均为铂电极),供选择的四组电解液列在下表中,要满足的条件是:(1)通电一段时间后甲池和乙池的pH值都下降,(2)电极C、A所得电解产物的物质的量之比为2:1,甲、乙两电池中电解液组号数是( )
按图装置进行电解实验(A、B、C、D均为铂电极),供选择的四组电解液列在下表中,要满足的条件是:(1)通电一段时间后甲池和乙池的pH值都下降,(2)电极C、A所得电解产物的物质的量之比为2:1,甲、乙两电池中电解液组号数是( )| 组号 | 甲 | 乙 |
| 1 | NaCl | AgNO3 |
| 2 | AgNO3 | CuCl2 |
| 3 | H2SO4 | AgNO3 |
| 4 | CuSO4 | HNO3 |
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 由图可知,A、C为阴极,B、D为阳极,通电一段时间后,甲、乙两池的pH均下降,则OH-放电或生成H+,电极C、A所得电解产物的物质的量之比为2:1,根据A、C上的电极反应来解答.
解答 解:A.电解NaCl溶液生成NaOH,pH增大,电解AgNO3溶液生成硝酸,pH下降,故A不选;
B.电解AgNO3溶液生成硝酸,pH下降,A为阴极电解生成金属银,电极反应为:2Ag++2e-=2Ag,电解CuCl2溶液生成的氯气与水反应生成酸,pH下降,C电极为阴极,电极反应为:Cu2++2e-=Cu,由电子守恒可知,Cu~2Ag,则电极C、A所得电解产物的物质的量之比为1:2,故B不选;
C.电解硫酸溶液,实质电解水,氢离子浓度变大,pH下降,A为阴极电解生成氢气,电极反应为:2H++2e-=H2↑,电解AgNO3溶液生成硝酸,pH下降,C电极为阴极,电极反应为:2Ag++2e-=2Ag,由电子守恒可知2Ag~H2,则电极C、A所得电解产物的物质的量之比为2:1,故C选;
D.电解CuSO4溶液生成硫酸,pH下降,A电极为阴极,电极反应为:Cu2++2e-=Cu,电解HNO3溶液实质电解水,氢离子浓度变大,pH下降,C为阴极电解生成氢气,电极反应为:2H++2e-=H2↑,由电子守恒可知,H2~Cu,则电极C、A所得电解产物的物质的量之比为1:1,故D不选;
故选C.
点评 本题考查电解原理,明确发生的电解反应及电子守恒判断A、C上的生成物是解答本题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.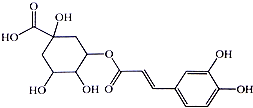 银翘的金银花与连翘配成的中成药,具有辛凉解表,清热解毒,用于流行感冒引起的发热、咳嗽、口干、咽喉肿痛.其中的一种具有较广泛的杀菌作用的有效成分--绿原酸,结构简式见图.下列描述错误的是( )
银翘的金银花与连翘配成的中成药,具有辛凉解表,清热解毒,用于流行感冒引起的发热、咳嗽、口干、咽喉肿痛.其中的一种具有较广泛的杀菌作用的有效成分--绿原酸,结构简式见图.下列描述错误的是( )
 银翘的金银花与连翘配成的中成药,具有辛凉解表,清热解毒,用于流行感冒引起的发热、咳嗽、口干、咽喉肿痛.其中的一种具有较广泛的杀菌作用的有效成分--绿原酸,结构简式见图.下列描述错误的是( )
银翘的金银花与连翘配成的中成药,具有辛凉解表,清热解毒,用于流行感冒引起的发热、咳嗽、口干、咽喉肿痛.其中的一种具有较广泛的杀菌作用的有效成分--绿原酸,结构简式见图.下列描述错误的是( )| A. | 绿原酸有可能通过酯化反应人工合成 | |
| B. | 1mol绿原酸能与4molBr2发生加成反应 | |
| C. | 1mol绿原酸能与6molNa发生置换反应 | |
| D. | 绿原酸能与NaHCO3溶液发生反应放出CO2 |
16.某二元弱酸H2A,在溶液中可以发生一级和二级电离:H2A?H++HA-,HA-?H++A2-,已知相同浓度时H2A比HA-容易电离,在相同温度时下列溶液中H2A浓度最大的是( )
| A. | 0.01 mol/L的H2A溶液 | |
| B. | 0.01 mol/L的NaHA溶液 | |
| C. | 0.02 mo|/L的NaOH溶液与0.02 mol/L的NaHA溶液等体积混合 | |
| D. | 0.02 mol/L的HCl溶液与0.04 mol/L的NaHA溶液等体积混合 |
13.如图为锌、铜和稀硫酸构成的原电池,下列说法不正确的是( )
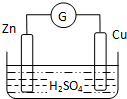

| A. | 外电路中电流由铜极流向锌极 | B. | 正极为电子流入的一极 | ||
| C. | 金属铜为负极 | D. | 发生还原反应的为正极 |
20.关于如图所示的原电池,下列说法不正确的是( )


| A. | 锌片发生氧化反应 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 铜片反应式为Cu2++2e-═Cu | D. | 该电池的反应本质是氧化还原反应 |
17.下列说法中正确的是( )
| A. | 形成离子键的阴、阳离子间只存在静电吸引力 | |
| B. | 核外电子排布相同的微粒,化学性质相同 | |
| C. | 所有物质中均存在化学键 | |
| D. | 离子化合物中一定含有离子键 |
 某学习小组针对化学能转变为其他形式的能量,进行如下实验:
某学习小组针对化学能转变为其他形式的能量,进行如下实验: