题目内容
20.关于如图所示的原电池,下列说法不正确的是( )
| A. | 锌片发生氧化反应 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 铜片反应式为Cu2++2e-═Cu | D. | 该电池的反应本质是氧化还原反应 |
分析 该原电池装置中,锌易失电子作负极,铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极.
解答 解:A.该装置中锌易失电子作负极,负极上失电子发生氧化反应,故A正确;
B.电子从负极锌沿导线流向正极铜,故B正确;
C.铜作正极,正极上氢离子得电子发生还原反应,反应式为:2H++2e-═H2↑,故C错误;
D.原电池工作时,本质是氧化还原反应,故D正确;
故选C.
点评 本题考查了原电池原理,根据电极上得失电子判断正负极,再结合电极反应类型、电子流向来分析解答,熟记原电池原理,难点是电极反应式的书写.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
14.下列实验描述符合事实的是( )
| A. | 钠暴露在空气中,表面变暗,生成白色固体氧化钠 | |
| B. | 用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼的白光,放出大量的热,产生白色固体 | |
| C. | 铜的化学性质很稳定,铜在任何条件下都不会生锈 | |
| D. | 用坩埚钳夹住铁丝在酒精灯上加热红热,迅速伸进氧气瓶中,剧烈燃烧火星四射,放出大量的热,生成红棕色的固体 |
8.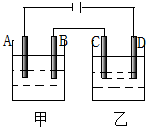 按图装置进行电解实验(A、B、C、D均为铂电极),供选择的四组电解液列在下表中,要满足的条件是:(1)通电一段时间后甲池和乙池的pH值都下降,(2)电极C、A所得电解产物的物质的量之比为2:1,甲、乙两电池中电解液组号数是( )
按图装置进行电解实验(A、B、C、D均为铂电极),供选择的四组电解液列在下表中,要满足的条件是:(1)通电一段时间后甲池和乙池的pH值都下降,(2)电极C、A所得电解产物的物质的量之比为2:1,甲、乙两电池中电解液组号数是( )
 按图装置进行电解实验(A、B、C、D均为铂电极),供选择的四组电解液列在下表中,要满足的条件是:(1)通电一段时间后甲池和乙池的pH值都下降,(2)电极C、A所得电解产物的物质的量之比为2:1,甲、乙两电池中电解液组号数是( )
按图装置进行电解实验(A、B、C、D均为铂电极),供选择的四组电解液列在下表中,要满足的条件是:(1)通电一段时间后甲池和乙池的pH值都下降,(2)电极C、A所得电解产物的物质的量之比为2:1,甲、乙两电池中电解液组号数是( )| 组号 | 甲 | 乙 |
| 1 | NaCl | AgNO3 |
| 2 | AgNO3 | CuCl2 |
| 3 | H2SO4 | AgNO3 |
| 4 | CuSO4 | HNO3 |
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
15.100mL浓度为2mol•L-1的盐酸跟过量的锌片反应,为加快反应速率,下列措施不可行的是( )
| A. | 加入适量的6 mol•L-1的盐酸 | B. | 加入适量蒸馏水 | ||
| C. | 加热 | D. | 用锌粉替代锌片 |
5.乙酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L乙酸溶液的pH值约为2 | |
| B. | 乙酸能与水以任何比例互溶 | |
| C. | 10mL1mol/L乙酸恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | 向CaCO3粉末中加入乙酸溶液有CO2气体生成 |
12.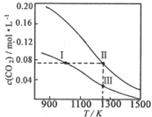 在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
 在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 状态Ⅱ和状态ⅢCO2的转化率相同 | |
| B. | 体系的总压强PⅢ:P总(状态Ⅱ)>2PⅠ (状态Ⅰ) | |
| C. | 反应的平衡常数:KⅠ>KⅡ=KⅢ | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
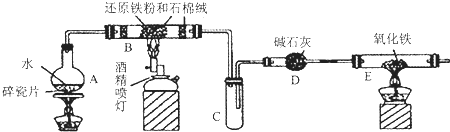
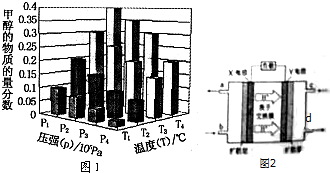 二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料,已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol.工业上制备二甲醚的主要方法经历了三个阶段:
二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料,已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol.工业上制备二甲醚的主要方法经历了三个阶段: