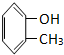
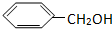
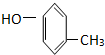
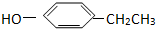
题目内容
13.如图为锌、铜和稀硫酸构成的原电池,下列说法不正确的是( )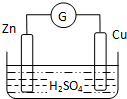
| A. | 外电路中电流由铜极流向锌极 | B. | 正极为电子流入的一极 | ||
| C. | 金属铜为负极 | D. | 发生还原反应的为正极 |
分析 锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,铜为正极,正极上氢离子得电子发生还原反应,电子从负极流向正极,以此解答.
解答 解:A、外电路中电流由正极铜极流向负极锌极,故A正确;
B、负极电子流出,正极电子流入,故B正确;
C、活泼的锌是负极,故C错误;
D、负极发生氧化反应,正极发生还原反应,故D正确;
故选C.
点评 本题考查原电池池知识,侧重于学生的分析能力和电化学知识的综合考查,注意把握电极方程式的书写,难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
7.某科研单位利用石油裂解的副产物CH4来制取CO和H2,其生产流程如图1:
(1)该流程第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图2.则P1<P2.(填“<”、“>”或“=”).该反应的平衡常数的表达式K=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$.
(2)此流程的第Ⅱ步反应的平衡常数随温度的变化如表:
①从上表分析推断,该反应是△H<0(填“<”、“>”或“=”).
②在500℃时,设起始时CO和H2O的起始浓度均为0.010mol/L-1,在该条件下,反应达到平衡时,CO的转化率为75%.
③如图3表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件可能是降低温度,或增加水蒸汽的量,或减少氢气的量(写出两种).
(1)该流程第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图2.则P1<P2.(填“<”、“>”或“=”).该反应的平衡常数的表达式K=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$.
(2)此流程的第Ⅱ步反应的平衡常数随温度的变化如表:
| 温度/℃ | 300 | 500 | 830 |
| 平衡常数K | 12 | 9 | 1 |
②在500℃时,设起始时CO和H2O的起始浓度均为0.010mol/L-1,在该条件下,反应达到平衡时,CO的转化率为75%.
③如图3表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件可能是降低温度,或增加水蒸汽的量,或减少氢气的量(写出两种).

1.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L Na2CO3溶液:C(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] | |
| B. | 0.1 mol/L NH4Cl溶液:C(NH4+ )=C(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:C(Na+)>C(CH3COO-)>C(H+)>C(OH-) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:C(Na+)>C(NO3-) |
8.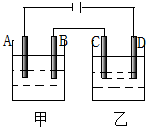 按图装置进行电解实验(A、B、C、D均为铂电极),供选择的四组电解液列在下表中,要满足的条件是:(1)通电一段时间后甲池和乙池的pH值都下降,(2)电极C、A所得电解产物的物质的量之比为2:1,甲、乙两电池中电解液组号数是( )
按图装置进行电解实验(A、B、C、D均为铂电极),供选择的四组电解液列在下表中,要满足的条件是:(1)通电一段时间后甲池和乙池的pH值都下降,(2)电极C、A所得电解产物的物质的量之比为2:1,甲、乙两电池中电解液组号数是( )
 按图装置进行电解实验(A、B、C、D均为铂电极),供选择的四组电解液列在下表中,要满足的条件是:(1)通电一段时间后甲池和乙池的pH值都下降,(2)电极C、A所得电解产物的物质的量之比为2:1,甲、乙两电池中电解液组号数是( )
按图装置进行电解实验(A、B、C、D均为铂电极),供选择的四组电解液列在下表中,要满足的条件是:(1)通电一段时间后甲池和乙池的pH值都下降,(2)电极C、A所得电解产物的物质的量之比为2:1,甲、乙两电池中电解液组号数是( )| 组号 | 甲 | 乙 |
| 1 | NaCl | AgNO3 |
| 2 | AgNO3 | CuCl2 |
| 3 | H2SO4 | AgNO3 |
| 4 | CuSO4 | HNO3 |
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
5.乙酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L乙酸溶液的pH值约为2 | |
| B. | 乙酸能与水以任何比例互溶 | |
| C. | 10mL1mol/L乙酸恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | 向CaCO3粉末中加入乙酸溶液有CO2气体生成 |
3. 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )| A. | CO合成甲醇的反应为吸热反应 | |
| B. | 处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$ 增大 | |
| C. | 平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})}$ | |
| D. | 该反应在T1时的平衡常数比T2时的小 |
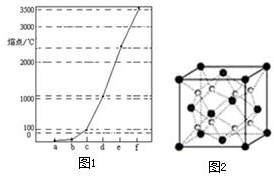 图1中a~f分别表示有H、C、N、Na、Si、Cu元素组成的单质,其中c、d均是热和电的良导体,单质分别对应的熔点如图所示:
图1中a~f分别表示有H、C、N、Na、Si、Cu元素组成的单质,其中c、d均是热和电的良导体,单质分别对应的熔点如图所示: