题目内容
2.硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S(aq)+Na2CO3(aq)+4SO2(aq)═3Na2S2O3(aq)+CO2(g)△H>0
实验小组在实验室用硫化碱法制备Na2S2O3.5SH2O流程如下:
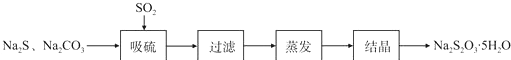
(1)吸硫装置如图所示.
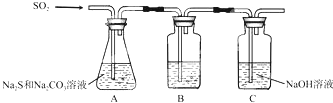
①装置B的作用是检验装置A中SO2的吸收效率,装置C的作用是吸收二氧化硫,防止污染空气
②为了提高SO2的吸收率,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外可采用合理的措施是
增大SO2的接触面积、控制SO2的流速、适当升高温度等(写出两条)
③假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验
已知:室温时BaCO3饱和溶液的pH=9.6)限选试剂及仪器:稀硝酸、AgNO3溶液、BaCl2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡 | 有白色沉淀生成 | 样品含NaCl |
| ② | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 加入过量BaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于9.6 | 样品含NaOH |
已知:IO3+5I+6H+═3I2+3H2O 2S2O32-+I2═S4O62-+2I-.
分析 (1)①装置B的作用是检验装置A中SO2的吸收效率,装置C的作用是吸收二氧化硫,防止污染空气;
②要使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是增大SO2的接触面积、控制SO2的流速、适当升高温度等;
③氯离子的检验可以利用硝酸酸化的硝酸银溶液;由于饱和BaCO3溶液的pH=9.6,所以可以先加入BaCl2溶液,然后测量溶液的pH值进行对比即可,判断是否含有NaOH;
(2)加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且30s内不不变色,说明滴定到达终点;
则根据反应式:IO3-+5I-+6H+=3I2+3H2O、2S2O32-+I2=S4O62-+2I-,可得关系式:IO3-~6S2O32-,据此计算c(Na2S2O3).
解答 解:(1)①装置B的作用是检验装置A中SO2的吸收效率,装置C的作用是吸收二氧化硫,防止污染空气,
故答案为:吸收二氧化硫,防止污染空气;
②要使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是增大SO2的接触面积、控制SO2的流速、适当升高温度等,
故答案为:增大SO2的接触面积、控制SO2的流速、适当升高温度等;
③氯离子的检验可以利用硝酸酸化的硝酸银溶液,有白色沉淀生成;由于饱和BaCO3溶液的pH=9.6,所以可以先加入BaCl2溶液,然后测量溶液的pH值进行对比即可,上层清液pH大于9.6,说明含有NaOH,同时有白色沉淀生成,
故答案为:
| 序号 | 实验操作 | 预期现象 |
| ① | 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡 | 有白色沉淀生成 |
| ② | 加入过量BaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于9.6 |
(2)加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且30s内不不变色,说明滴定到达终点;
ag KIO3的物质的量是$\frac{a}{214}$mol,则根据反应式:IO3-+5I-+6H+=3I2+3H2O、2S2O32-+I2=S4O62-+2I-,
可得关系式:IO3-~~~~~6S2O32-
1mol 6mol
$\frac{a}{214}$mol $\frac{a}{214}$mol×6
所以c(Na2S2O3)=($\frac{a}{214}$mol×6)÷0.001V L=$\frac{6000a}{214V}$mol/L,
故答案为:加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且30s内不不变色;$\frac{6000a}{214V}$mol/L.
点评 本题考查物质组成探究实验方案设计、对装置与操作的分析评价氧化还原滴定的应用、化学计算等,属于拼合型题目,难度中等,是对知识的综合运用与分析解决问题能力的考查,注意利用关系式进行计算.

| A. | 原子最外层电子数:X>Y>Z | B. | 单质活泼性:X>Y>Z | ||
| C. | 原子序数:X>Y>Z | D. | 离子半径:X2->Y+>Z- |
| A. | 醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水里,加入NH4C1至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)<c(Na+) |
①NH4Cl与NaOH ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NaHCO3
下列各项正确的是( )
| A. | PH大小顺序①>④>③>② | |
| B. | C(NH3•H2O)大小顺序:②>④>③>① | |
| C. | 混合溶液④中存在C(NH3•H2O)+C(CO32-)+C(H+)=C(OH-)+C(H2CO3) | |
| D. | 混合溶液③中水的电离被促进,其中C(H+)和C(OH-)均大于1.0×10-7mol/L |
| A. | 单质的化学活泼性:W<X<Y<Z | B. | 单质的氧化能力:W>X>Y>Z | ||
| C. | 原子最外层电子数:W<X<Y<Z | D. | 元素的最高化合价:W<X<Y<Z |
| A. | 由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+3OHˉ=Al(OH)3 | |
| C. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-=Fe2+ | |
| D. | 由Fe、Cu、浓硝酸组成的原电池,开始时其负极反应式为:Cu-2e-=Cu2+ |
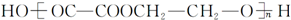 的合成路线如下:[括号内为反应类型,□内为目标产物]
的合成路线如下:[括号内为反应类型,□内为目标产物]
 的化学反应方程式nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$
的化学反应方程式nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$ +(2n-1)H2O.
+(2n-1)H2O.