题目内容
11.某无色混合气体由等质量的CO和X(X为甲烷或乙烯)组成,为确定X的成分,进行如下实验:取2.24L(标准状况)该混合气体在足量的氧气中燃烧,并将燃烧后的产物通入如图Ⅰ所示的装置中
Ⅰ定量分析
(1)实验前后装置A增重1.8g
(2)装置B中发生反应的离子方程式为CO2+Ca2++2OH-=CaCO3↓+H2O,经测定,实验前后装置B增重4.4g,则X的结构简式为CH4
Ⅱ定性分析
将一定量于按混合气体通入如图Ⅱ所示实验装置,结合Ⅰ中结论完成下列实验内容
(3)装置甲中的实验现象为溴水不褪色;装置乙中的实验现象为试管内气体颜色变浅,试管内壁有油状液滴出现
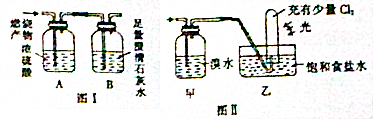
分析 (1)气体总物质的量为0.1mol,由于CO和X物质的量相等,因此X为0.05mol,CO燃烧产生CO2,X燃烧产生CO2和H2O,浓硫酸只吸收H2O,又由于甲烷和乙烯分子中均有4个氢,因此0.05mol甲烷或乙烯燃烧均产生0.1molH2O,所以浓硫酸增重1.8g;
(2)澄清石灰水吸收二氧化碳;经测定,实验前后装置B增重4.4g,n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,则0.05molX含有0.05molCO2,X含有一个碳原子,X为甲烷;
(3)甲烷与溴水不反应;光照条件下,甲烷与氯气发生取代反应.
解答 解:(1)气体总物质的量为0.1mol,由于CO和X物质的量相等,因此X为0.05mol,CO燃烧产生CO2,X燃烧产生CO2和H2O,浓硫酸只吸收H2O,又由于甲烷和乙烯分子中均有4个氢,因此0.05mol甲烷或乙烯燃烧均产生0.1molH2O,所以浓硫酸增重1.8g;
故答案为:1.8;
(2)澄清石灰水吸收二氧化碳,离子方程式为CO2+Ca2++2OH-=CaCO3↓+H2O;经测定,实验前后装置B增重4.4g,n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,则0.05molX含有0.05molCO2,X含有一个碳原子,X为甲烷;
故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O;CH4;
(3)甲烷与溴水不反应;光照条件下,甲烷与氯气发生取代反应,试管内气体颜色变浅,试管内壁有油状液滴出现;
故答案为:溴水不褪色;试管内气体颜色变浅,试管内壁有油状液滴出现.
点评 本题考查有机物分子式的确定及其性质,难度不大,根据浓硫酸增重、澄清石灰增重求出H2O、CO2是解题的关键.

练习册系列答案
相关题目
1.碳元素有的三种原子:${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C,下列各项对三种原子均不同的是( )
| A. | 元素种类 | B. | 核电荷数 | C. | 电子层数 | D. | 中子数 |
19.下列说法正确的是( )
| A. | 含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 | |
| B. | 500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中充分反应生成NH3(g),放热7.72kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 对于可逆反应N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g),△H<O;升高温度,可使反应速率增大,反应逆向移动 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
2.硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:
2Na2S(aq)+Na2CO3(aq)+4SO2(aq)═3Na2S2O3(aq)+CO2(g)△H>0
实验小组在实验室用硫化碱法制备Na2S2O3.5SH2O流程如下: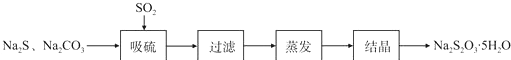
(1)吸硫装置如图所示.
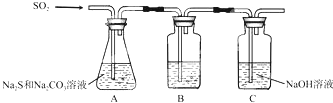
①装置B的作用是检验装置A中SO2的吸收效率,装置C的作用是吸收二氧化硫,防止污染空气
②为了提高SO2的吸收率,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外可采用合理的措施是
增大SO2的接触面积、控制SO2的流速、适当升高温度等(写出两条)
③假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验
已知:室温时BaCO3饱和溶液的pH=9.6)限选试剂及仪器:稀硝酸、AgNO3溶液、BaCl2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
(2)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶溶液的体积为V mL.则滴定的终点的实验现象是加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且30s内不不变色c(Na2S2O3)=$\frac{6000a}{214V}$mol/L.(用含“a”“V”算式表示)
已知:IO3+5I+6H+═3I2+3H2O 2S2O32-+I2═S4O62-+2I-.
2Na2S(aq)+Na2CO3(aq)+4SO2(aq)═3Na2S2O3(aq)+CO2(g)△H>0
实验小组在实验室用硫化碱法制备Na2S2O3.5SH2O流程如下:

(1)吸硫装置如图所示.

①装置B的作用是检验装置A中SO2的吸收效率,装置C的作用是吸收二氧化硫,防止污染空气
②为了提高SO2的吸收率,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外可采用合理的措施是
增大SO2的接触面积、控制SO2的流速、适当升高温度等(写出两条)
③假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验
已知:室温时BaCO3饱和溶液的pH=9.6)限选试剂及仪器:稀硝酸、AgNO3溶液、BaCl2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡 | 有白色沉淀生成 | 样品含NaCl |
| ② | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 加入过量BaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于9.6 | 样品含NaOH |
已知:IO3+5I+6H+═3I2+3H2O 2S2O32-+I2═S4O62-+2I-.
19.放射性同位素14C可用来推算文物的“年龄”.14C的含量每减少一半要经过约5730年.某考古小组挖掘到一块动物骨骼,经测定14C还剩余$\frac{1}{8}$,推测该动物生存年代距今约为( )
| A. | 5730×3年 | B. | 5730×4年 | C. | 5730×6年 | D. | 5730×8年 |
20.下列说法正确的是( )
| A. | 有机化合物都是从有机体中提炼出来的 | |
| B. | 有机物和无机物的性质完全不同 | |
| C. | 所有有机物均含有碳元素 | |
| D. | 所有有机物均含有氢元素 |
 如表为元素周期表短周期的一部分.回答下列问题:
如表为元素周期表短周期的一部分.回答下列问题:
 ,该反应属于取代反应,有机物的名称是硝基苯.
,该反应属于取代反应,有机物的名称是硝基苯.