题目内容
11.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中不正确的是( )| A. | 由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+3OHˉ=Al(OH)3 | |
| C. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-=Fe2+ | |
| D. | 由Fe、Cu、浓硝酸组成的原电池,开始时其负极反应式为:Cu-2e-=Cu2+ |
分析 A.原电池放电时,铝易失去电子而作负极;
B.原电池中,失电子发生氧化反应的电极是负极,该原电池中,铝和氢氧化钠反应而失去电子,则铝作负极;
C.原电池中,负极上失电子发生氧化反应,该原电池中,铁易失去电子而作负极;
D.Al、Cu、浓硝酸组成的原电池中,铝和浓硝酸发生钝化现象,铜和浓硝酸发生反应而失去电子,则铜作负极,用此电极电解硝酸银时,根据转移电子数相等计算消耗铜的质量.
解答 解:A.该原电池中,铝易失去电子而作负极,负极反应式为:Al-3e-=Al3+,放电时,故A正确;
B、由Mg、Al、NaOH溶液组成原电池,铝和氢氧化钠反应易失去电子而作负极,镁作正极,其负极反应式为:Al-3e-+4OH-═AlO2-+2H2O,故B错误;
C.该原电池中,铁易失去电子而作负极,铜作正极,其负极反应式为:Fe-2e-═Fe2+,故C正确;
D、Al、Cu、浓硝酸组成原电池作电源,铜作负极,负极反应式为:Cu-2e-=Cu2+,故D正确;
故选B.
点评 本题考查了原电池原理,易错选项是B和D,注意不能根据金属的活泼性确定原电池的正负极,要根据电极反应类型判断原电池的正负极,为易错点.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
2.硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:
2Na2S(aq)+Na2CO3(aq)+4SO2(aq)═3Na2S2O3(aq)+CO2(g)△H>0
实验小组在实验室用硫化碱法制备Na2S2O3.5SH2O流程如下: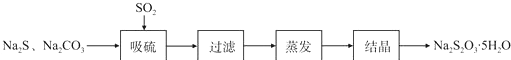
(1)吸硫装置如图所示.
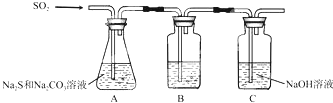
①装置B的作用是检验装置A中SO2的吸收效率,装置C的作用是吸收二氧化硫,防止污染空气
②为了提高SO2的吸收率,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外可采用合理的措施是
增大SO2的接触面积、控制SO2的流速、适当升高温度等(写出两条)
③假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验
已知:室温时BaCO3饱和溶液的pH=9.6)限选试剂及仪器:稀硝酸、AgNO3溶液、BaCl2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
(2)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶溶液的体积为V mL.则滴定的终点的实验现象是加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且30s内不不变色c(Na2S2O3)=$\frac{6000a}{214V}$mol/L.(用含“a”“V”算式表示)
已知:IO3+5I+6H+═3I2+3H2O 2S2O32-+I2═S4O62-+2I-.
2Na2S(aq)+Na2CO3(aq)+4SO2(aq)═3Na2S2O3(aq)+CO2(g)△H>0
实验小组在实验室用硫化碱法制备Na2S2O3.5SH2O流程如下:

(1)吸硫装置如图所示.

①装置B的作用是检验装置A中SO2的吸收效率,装置C的作用是吸收二氧化硫,防止污染空气
②为了提高SO2的吸收率,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外可采用合理的措施是
增大SO2的接触面积、控制SO2的流速、适当升高温度等(写出两条)
③假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验
已知:室温时BaCO3饱和溶液的pH=9.6)限选试剂及仪器:稀硝酸、AgNO3溶液、BaCl2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡 | 有白色沉淀生成 | 样品含NaCl |
| ② | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 加入过量BaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于9.6 | 样品含NaOH |
已知:IO3+5I+6H+═3I2+3H2O 2S2O32-+I2═S4O62-+2I-.
19.放射性同位素14C可用来推算文物的“年龄”.14C的含量每减少一半要经过约5730年.某考古小组挖掘到一块动物骨骼,经测定14C还剩余$\frac{1}{8}$,推测该动物生存年代距今约为( )
| A. | 5730×3年 | B. | 5730×4年 | C. | 5730×6年 | D. | 5730×8年 |
20.下列说法正确的是( )
| A. | 有机化合物都是从有机体中提炼出来的 | |
| B. | 有机物和无机物的性质完全不同 | |
| C. | 所有有机物均含有碳元素 | |
| D. | 所有有机物均含有氢元素 |
1.下列物质中,不能与小苏打反应的是( )?
| A. | 甲酸 | B. | 乙酸 | C. | 硫酸 | D. | 乙醇 |
 如表为元素周期表短周期的一部分.回答下列问题:
如表为元素周期表短周期的一部分.回答下列问题:


 .
. 按1:1恰好反应生成两种酸性有机物,则另一种有机物的名称为乙酸.
按1:1恰好反应生成两种酸性有机物,则另一种有机物的名称为乙酸. .试剂c最好选用C(填字母序号).
.试剂c最好选用C(填字母序号). .
.