题目内容
19.铁、铝、铜及其化合物在生成、生活中有着广泛的应用.请回答下列问题:(1)铝元素在周期表中位置第三周期第ⅢA族,铝离子的结构示意图为
 .
.(2)Fe3+、Al3+、Cu2+三种金属阳离子氧化性有强到弱的排列顺序是Fe3+>Cu2+>Al3+,制造电路板的工艺中,FeCl3溶液可以蚀刻钢箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)与明矾相似,硫酸铁也可用作净水剂,但在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+,酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(4)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是BC(填写字母序号).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 铝箔在酒精灯火焰上加热融化但不滴落 | 铝箔对熔化的铝有较强的吸附作用 | Ⅰ对;Ⅱ错. |
| C | 铝粉可以和氧化铁粉末发生铝热反应 | 铝热反应是工业炼铁最常用方法 | Ⅰ对;Ⅱ错. |
| D | 铜在潮湿空气中表面会生成铜绿 | 可用铜容器盛放浓硫酸 | Ⅰ对;Ⅱ对. |
分析 (1)铝原子结构中有3个电子层,最外层电子数为3,离子核外有10个电子;
(2)金属越活泼,对应阳离子的氧化性越弱,FeCl3溶液与铜反应生成氯化亚铁和氯化铜;
(3)硫酸铁可用作絮凝剂的原理为三价铁离子水解生成氢氧化铁的胶体具有吸附性,但在酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体;
(4)A.地壳中含量最高的金属元素是铝,人类最早使用的金属材料是铜;
B.氧化铝的熔点高;
C.铝热反应为放热反应,可用来冶炼熔点高的金属;
D.Cu性质不活泼,常温下与浓硫酸不反应;
(5)合金溶于过量盐酸铁和铝反应,剩余固体质量为硅的质量,计算得到n(Si),加入过量氢氧化钠溶液铝离子反应全部变化为偏铝酸钠,铁离子生成氢氧化铁过滤、洗涤得固体.再将所得固体充分加热、灼烧,得红棕色粉末1.60g为Fe2O3,计算得到铁元素物质的量,结合质量守恒计算合金中铝元素物质的量得到化学式.
解答 解:(1)铝的原子结构示意图为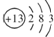 ,Al位于周期表中第三周期第ⅢA族,铝离子核内有13个质子,核外有10个电子,则铝离子的结构示意图为
,Al位于周期表中第三周期第ⅢA族,铝离子核内有13个质子,核外有10个电子,则铝离子的结构示意图为 ,
,
故答案为:第三周期第ⅢA族; ;
;
(2)FeCl3溶液可以蚀刻铜箔,因为铁离子具有氧化性,将铜单质氧化生成铜离子和亚铁离子,反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+,则氧化性为Fe3+>Cu2+,金属越活泼,对应阳离子的氧化性越弱,可知氧化性为Cu2+>Al3+,则Fe3+、Al3+、Cu2+三种金属阳离子氧化性有强到弱的排列顺序是Fe3+>Cu2+>Al3+,
故答案为:Fe3+>Cu2+>Al3+;2Fe3++Cu=2Fe2++Cu2+;
(3)硫酸铁可用作絮凝剂的原理为三价铁离子水解生成氢氧化铁的胶体具有吸附性,但在酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体,
故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+,酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体;
(4)A.地壳中含量最高的金属元素是铝,人类最早使用的金属材料是铜,判断均不合理,故A错误;
B.氧化铝的熔点高,包裹在铝的外面,则铝箔在酒精灯火焰上加热融化但不滴落,判断合理,故B正确;
C.铝热反应为放热反应,可用来冶炼熔点高的金属,工业炼铁为高炉炼铁,利用热还原法,判断合理,故C正确;
D.Cu性质不活泼,常温下与浓硫酸不反应,但不用铜容器盛放浓硫酸,一般利用Fe、Al容器盛放浓硫酸,故D错误;
故答案为:BC;
(5)1.46g该合金粉末,加入过量盐酸溶液,充分反应后过滤,铁和铝全部溶解,测定剩余固体质量0.07g为硅.n(Si)=$\frac{0.07g}{28g/mol}$=0.0025mol,向滤液中滴加足量NaOH浓溶液,铝离子反应生成偏铝酸钠,充分搅拌、过滤、洗涤得固体.判断为Fe(OH)3,再将所得固体充分加热、灼烧,得红棕色粉末1.60g为Fe2O3,铁的物质的量n(Fe)=$\frac{1.60g}{160g/mol}$×2=0.02mol,n(Al)=$\frac{1.46g-0.07g-0.02mol×56g/mol}{27g/mol}$=0.01mol;n(Fe):n(Al):n(Si)=0.02:0.01:0.0025=8:4:1,即化学式为Fe8Al4Si,故答案为:Fe8Al4Si.
点评 本题考查较综合,涉及金属及化合物的性质、盐类水解、氧化还原反应、物质组成的确定等,综合性较强,把握相关反应原理为解答的关键,侧重分析与应用能力的综合考查,题目难度中等.

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案| A. | 4.5mol•L-1 | B. | 5mol•L-1 | C. | 6mol•L-1 | D. | 8mol•L-1 |
| A. | 溴水 | B. | 酸性髙锰酸钾溶液 | ||
| C. | 碳酸钠溶液 | D. | 紫色石蕊溶液 |
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 油脂和汽油都属于酯类,都能用作工业制肥皂 | |
| C. | 纯碱可用于生成普通玻璃,日常生活中也可能用初年溶液来除去物品表面的油污 | |
| D. | 雾霾严重影响了人们的正常生活,为改善空气质量,可以加高工厂的烟囱,使灰尘和废气远离地表 |
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
| A. | 硅是半导体材料,可用于制备光导纤维 | |
| B. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | Al2O3熔点高,可用于制作耐高温仪器 |
| A. | 吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒 | |
| B. | 移液管放液时,将移液管稍倾斜放入直立的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 | |
| C. | 生物体死亡后,体内含有的碳-14会逐渐减少,因此可通过测量生物体遗骸中碳-14的含量,来计算它存活的年代.碳-14减少的变化为化学变化 | |
| D. | 当用电解法除去溶液中的Cr2O72-离子时,因其具有强氧化性易得电子,故可在阴极直接放电生成Cr3+,最后生成Cr(OH)3沉淀除去 |
 .W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)