题目内容
14.反应2SO2+O2?2SO3(g)经一段时间后,SO3的浓度增加了0.2mol/L,在这段时间内用O2表示的反应速率为0.01mol•L-1•s-1,则这段时间为( )| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
分析 同一可逆反应中,同一时间段内各物质的反应速率之比等于其计量数之比,在这段时间内用O2表示的反应速率为0.01mol•L-1•s-1,则三氧化硫的反应速率为0.02mol•L-1•s-1,根据v=$\frac{△c}{△t}$计算反应时间.
解答 解:同一可逆反应中,同一时间段内各物质的反应速率之比等于其计量数之比,在这段时间内用O2表示的反应速率为0.01mol•L-1•s-1,则三氧化硫的反应速率为0.02mol•L-1•s-1,根据v=$\frac{△c}{△t}$得反应时间=$\frac{△c}{v}$=$\frac{0.2mol/L}{0.02mol/(L.s)}$=10s,故选D.
点评 本题考查化学反应速率有关计算,明确化学反应速率与其计量数的关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
4.某元素X的最高价含氧酸的化学式为HnXO2n-2,则在某气态氢化物中,X元素的化合价为( )
| A. | 5n-12 | B. | 3n-12 | C. | 3n-6 | D. | n-10 |
2.在常温下,三氯化铁溶于适量蒸馏水能形成低浓度的氢氧化铁胶体,下列叙述不正确的是( )
| A. | 由三氯化铁到氢氧化铁胶体有发生化学变化发生 | |
| B. | 氢氧化铁胶体溶液的颗粒的直径在10-9~10-7m之间 | |
| C. | 可以用丁达尔效应实验有效鉴别氯化钠溶液和氢氧化铁溶液 | |
| D. | 三氯化铁可用作净水剂 |
9.设NA为阿伏伽德罗常数的数值,下列叙述中正确的是( )
| A. | 3.2gO2和O3混合气体所含的氧原子总数为0.2NA | |
| B. | 一定条件下,2 mol SO2和1mol O2在密闭容器中充分反应后,容器内气体分子总数为2NA | |
| C. | 12g金刚石含4NA个C-C键 | |
| D. | 0.1 mol Na在空气中完全燃烧生成Na2O2,转移的电子数为0.2NA |
19.铁、铝、铜及其化合物在生成、生活中有着广泛的应用.请回答下列问题:
(1)铝元素在周期表中位置第三周期第ⅢA族,铝离子的结构示意图为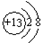 .
.
(2)Fe3+、Al3+、Cu2+三种金属阳离子氧化性有强到弱的排列顺序是Fe3+>Cu2+>Al3+,制造电路板的工艺中,FeCl3溶液可以蚀刻钢箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)与明矾相似,硫酸铁也可用作净水剂,但在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+,酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(4)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是BC(填写字母序号).
(5)某兴趣小组为测定一种铁铝硅合金(Fe2Al3Si2)粉末的组成,提出如下方案:准备称取1.46g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07g.向滤液汇总滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体.再将所得固体充分加热、灼烧,得到红棕色粉末1.60g.通过计算确定次合金的组成为Fe8Al4Si(填化学式).
(1)铝元素在周期表中位置第三周期第ⅢA族,铝离子的结构示意图为
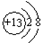 .
.(2)Fe3+、Al3+、Cu2+三种金属阳离子氧化性有强到弱的排列顺序是Fe3+>Cu2+>Al3+,制造电路板的工艺中,FeCl3溶液可以蚀刻钢箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)与明矾相似,硫酸铁也可用作净水剂,但在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+,酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(4)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是BC(填写字母序号).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 铝箔在酒精灯火焰上加热融化但不滴落 | 铝箔对熔化的铝有较强的吸附作用 | Ⅰ对;Ⅱ错. |
| C | 铝粉可以和氧化铁粉末发生铝热反应 | 铝热反应是工业炼铁最常用方法 | Ⅰ对;Ⅱ错. |
| D | 铜在潮湿空气中表面会生成铜绿 | 可用铜容器盛放浓硫酸 | Ⅰ对;Ⅱ对. |
17.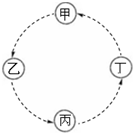 甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化).下列各组物质中,不能满足图示转化关系的是( )
甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化).下列各组物质中,不能满足图示转化关系的是( )
 甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化).下列各组物质中,不能满足图示转化关系的是( )
甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化).下列各组物质中,不能满足图示转化关系的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | Fe | FeCl3 | Fe (OH)3 | Fe2O3 |
| B | NaAlO2 | Al (OH)3 | Al2O3 | Al |
| C | Na | Na2O2 | Na2CO3 | NaCl |
| D | SiO2 | H2SiO3 | Na2SiO3 | Si |
| A. | A | B. | B | C. | C | D. | D |
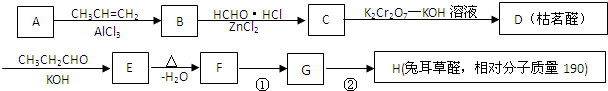
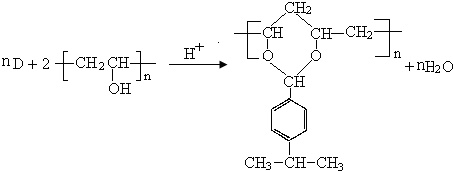
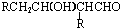 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$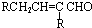
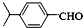 .
. .
. .
.