题目内容
3.下列关于实验原理或操作的叙述中,正确的是( )| A. | 吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒 | |
| B. | 移液管放液时,将移液管稍倾斜放入直立的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 | |
| C. | 生物体死亡后,体内含有的碳-14会逐渐减少,因此可通过测量生物体遗骸中碳-14的含量,来计算它存活的年代.碳-14减少的变化为化学变化 | |
| D. | 当用电解法除去溶液中的Cr2O72-离子时,因其具有强氧化性易得电子,故可在阴极直接放电生成Cr3+,最后生成Cr(OH)3沉淀除去 |
分析 A.酒精和乙醚具有麻醉作用,减弱对呼吸道的刺激,减轻咳嗽;
B.移液管放液时,移液管不能接触容器内壁;
C.碳-14减少时没有新物质生成;
D.电解时,阴离子向阳极移动.
解答 解:A.酒精和乙醚具有麻醉作用,减弱对呼吸道的刺激,减轻咳嗽,则实验室中吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒,故A正确;
B.移液管放液时,移液管不能接触容器内壁,否则会污染溶液,故B错误;
C.碳-14减少时没有新物质生成,所以不是化学变化,故C错误;
D.电解时,阴离子向阳极移动,所以Cr2O72-离子向阳极移动,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及实验安全、基本操作、电解原理等知识点,综合性较强,侧重考查基本原理和基本操作,明确实验原理是解本题关键,易错选项是D.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.铁、铝、铜及其化合物在生成、生活中有着广泛的应用.请回答下列问题:
(1)铝元素在周期表中位置第三周期第ⅢA族,铝离子的结构示意图为 .
.
(2)Fe3+、Al3+、Cu2+三种金属阳离子氧化性有强到弱的排列顺序是Fe3+>Cu2+>Al3+,制造电路板的工艺中,FeCl3溶液可以蚀刻钢箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)与明矾相似,硫酸铁也可用作净水剂,但在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+,酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(4)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是BC(填写字母序号).
(5)某兴趣小组为测定一种铁铝硅合金(Fe2Al3Si2)粉末的组成,提出如下方案:准备称取1.46g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07g.向滤液汇总滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体.再将所得固体充分加热、灼烧,得到红棕色粉末1.60g.通过计算确定次合金的组成为Fe8Al4Si(填化学式).
(1)铝元素在周期表中位置第三周期第ⅢA族,铝离子的结构示意图为
 .
.(2)Fe3+、Al3+、Cu2+三种金属阳离子氧化性有强到弱的排列顺序是Fe3+>Cu2+>Al3+,制造电路板的工艺中,FeCl3溶液可以蚀刻钢箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)与明矾相似,硫酸铁也可用作净水剂,但在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+,酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(4)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是BC(填写字母序号).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 铝箔在酒精灯火焰上加热融化但不滴落 | 铝箔对熔化的铝有较强的吸附作用 | Ⅰ对;Ⅱ错. |
| C | 铝粉可以和氧化铁粉末发生铝热反应 | 铝热反应是工业炼铁最常用方法 | Ⅰ对;Ⅱ错. |
| D | 铜在潮湿空气中表面会生成铜绿 | 可用铜容器盛放浓硫酸 | Ⅰ对;Ⅱ对. |
14.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,7.0g乙烯与丙稀的混合物中含有氢原子的数目为NA | |
| C. | 50mL18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
11.已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+.下列有关的离子方程式正确的是( )
| A. | 向能使PH试纸显深蓝色的溶液中通入少量二氧化碳:OH-+CO2═HCO3- | |
| B. | 向NaClO溶液中加入浓氢溴酸:ClO-+2H++2 Br-═Cl-+Br2+H2O | |
| C. | 向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 向FeBr2溶液中滴加少量HClO溶液:2Fe2++HClO═2Fe3++Cl-+OH- |
8.已知酸性: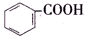 >H2CO3>
>H2CO3>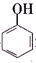 >HCO${\;}_{3}^{-}$,现将
>HCO${\;}_{3}^{-}$,现将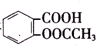 转变为
转变为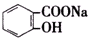 ,可行的方法是( )
,可行的方法是( )
 >H2CO3>
>H2CO3> >HCO${\;}_{3}^{-}$,现将
>HCO${\;}_{3}^{-}$,现将 转变为
转变为 ,可行的方法是( )
,可行的方法是( )| A. | 向该溶液中加入足量的稀硫酸,加热 | |
| B. | 将该物质与稀硫酸共热后,再加入足量的NaOH溶液 | |
| C. | 将该物质与稀硫酸共热后,再加入足量的Na2CO3溶液 | |
| D. | 将该物质与足量的NaOH溶液共热,再通入足量CO2气体 |
15.下列说法不正确的是( )
| A. | 在一定条件下,使煤和氢气作用,可以得到液体燃料,也可以获得洁净的燃料油 | |
| B. | (CH3)2CHCH(CH3)2的系统命名为:2,3-二甲基丁烷 | |
| C. | 硬脂酸甘油酯可以在稀硫酸中水解,也可以在NaOH溶液中发生皂化反应彻底水解 | |
| D. | 氨基酸分子中均含有氨基和羧基,加入浓的硫酸钠溶液可从溶液中析出 |
13.木糖醇是一种新型的甜味剂,是一种理想的蔗糖代替品,它具有甜味适中,溶解性好,适合糖尿病患者等优点,结构简式为:CH2OH(CHOH)3CH2OH.下列有关木糖醇的叙述正确的是( )
| A. | 木糖醇与核糖(C3H10O3)互为同分异构体 | |
| B. | 木糖醇与甘油(CH2OHCHOHCH2OH)互为同系物 | |
| C. | 木糖醇可以与乙酸发生酯化反应 | |
| D. | 木糖醇与葡萄一样是一种单糖 |
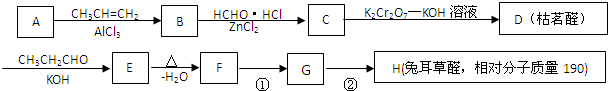
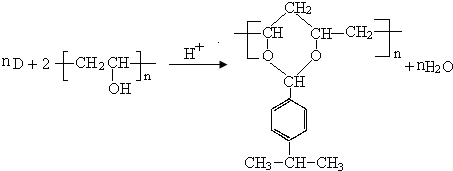
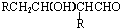 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$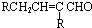
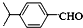 .
.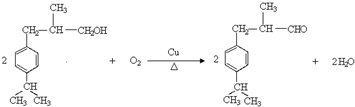 .
.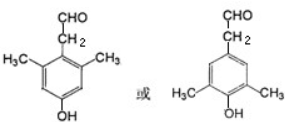 .
.