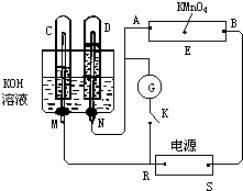
题目内容
4.A、B、C、D均为中学化学常见的纯净物,A是单质,它们之间有如图所示的反应关系.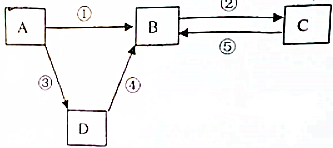
(1)若A可用于制造晶体管和集成电路,B、C为钠盐,C广泛用于玻璃、造纸等工业,写出C的化学式Na2CO3,反应①的离子方程式Si+2OH-+H2O=SiO32-+2H2↑,反应⑤的化学方程式为Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2 ↑;
(2)若A是淡黄色固体,B是造成酸雨的主要物质之一,D是氢化物,②反应是B的水溶液中通入一种黄绿色气体,生成C和E,反应④的化学方程式为2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O;
(3)若D是气态氢化物,B、C是氧化物且会造成光化学烟雾污染,反应③的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,B与D在催化剂加热条件下反应生成A是大气主要成分,该反应的化学方程式为4NH3+6NO$\frac{\underline{催化剂}}{△}$5N2+6H2O.
分析 根据题中各物质转化关系,
(1)若A是太阳能电池用的光伏材料,判断A为Si.B、C为钠盐,C广泛用于玻璃、造纸等工业,则C为Na2CO3,B为Na2SiO3,则D为SiO2;
(2)若A是淡黄色固体,B是造成酸雨的主要物质之一,则A为S,B为SO2,D是氢化物,则D为H2S,②反应是SO2的水溶液中通入一种黄绿色气体为氯气,生成硫酸和盐酸,符合题中各物质转化关系;
(3)若B是气态氢化物.B、C是氧化物且会造成光化学烟雾污染,判断为NO、NO2,氮气与氧气反应生成一氧化氮,所以B为NO,C为NO2,B与C在一定条件下反应生成的A是大气主要成分,推断A为N2,D为NH3,依据推断出的物质书写化学方程式.
解答 解:(1)若A是太阳能电池用的光伏材料,判断A为Si.B、C为钠盐,C广泛用于玻璃、造纸等工业,则C为Na2CO3,B为Na2SiO3,则D为SiO2,反应①的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑,反应⑤的化学方程式为Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2 ↑,
故答案为:Na2CO3;Si+2OH-+H2O=SiO32-+2H2↑;Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2 ↑;
(2)若A是淡黄色固体,B是造成酸雨的主要物质之一,则A为S,B为SO2,D是氢化物,则D为H2S,②反应是SO2的水溶液中通入一种黄绿色气体为氯气,生成硫酸和盐酸,反应④的化学方程式为2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,
故答案为:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O;
(3)若B是气态氢化物.B、C是氧化物且会造成光化学烟雾污染,判断为NO、NO2,氮气与氧气反应生成一氧化氮,所以B为NO,C为NO2,B与C在一定条件下反应生成的A是大气主要成分,推断A为N2,D为NH3,③反应的化学方程式为为N2+3H2$?_{催化剂}^{高温高压}$2NH3,NH3与NO在催化剂加热条件下反应生成氮气的化学方程式为4NH3+6NO$\frac{\underline{催化剂}}{△}$5N2+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;4NH3+6NO$\frac{\underline{催化剂}}{△}$5N2+6H2O.
点评 本题考查了物质转化关系的应用和性质应用,主要考查硫及其化合物性质、氮及其化合物、硅及其化合物性质的综合应用,用好条件是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 电解法、热分解法、热还原法 | B. | 热分解法、电解法、热还原法 | ||
| C. | 热还原法、热分解法、热还原法 | D. | 电解法、电解法、热分解法 |
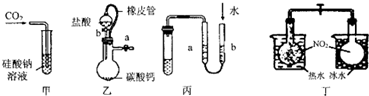
| A. | 甲装置:可用来证明碳的非金属性比硅强 | |
| B. | 乙装置:橡皮管的作用是保证装置不漏气 | |
| C. | 丙装置:用图示的方法检查此装置的气密性 | |
| D. | 丁装置:探究温度对平衡的影响 |
(1)铝元素在周期表中位置第三周期第ⅢA族,铝离子的结构示意图为
 .
.(2)Fe3+、Al3+、Cu2+三种金属阳离子氧化性有强到弱的排列顺序是Fe3+>Cu2+>Al3+,制造电路板的工艺中,FeCl3溶液可以蚀刻钢箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)与明矾相似,硫酸铁也可用作净水剂,但在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+,酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(4)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是BC(填写字母序号).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 铝箔在酒精灯火焰上加热融化但不滴落 | 铝箔对熔化的铝有较强的吸附作用 | Ⅰ对;Ⅱ错. |
| C | 铝粉可以和氧化铁粉末发生铝热反应 | 铝热反应是工业炼铁最常用方法 | Ⅰ对;Ⅱ错. |
| D | 铜在潮湿空气中表面会生成铜绿 | 可用铜容器盛放浓硫酸 | Ⅰ对;Ⅱ对. |
| A. | 制取二氧化氮时,用水或NaOH溶液吸收尾气 | |
| B. | 用将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红的方法来检验Fe(NO3)2晶体是否变质 | |
| C. | 锥形瓶可用作加热的反应器 | |
| D. | 只滴加氨水可以鉴别出NaCl、AlCl3、Na2SO4、MgCl2四种溶液 |
| A. | 工业上常用电解熔融D的氧化物来制备D的单质 | |
| B. | 单质C、D着火,灭火时C不能用泡沫灭火器,但D可以用泡沫灭火器灭火 | |
| C. | 化合物A2B2与C2B2所含化学键类型完全相同 | |
| D. | A、B、C组成的化合物,若溶液浓度为0.01mol/L,则由水电离出的OH-为10-12mol/L |
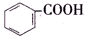 >H2CO3>
>H2CO3>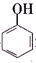 >HCO${\;}_{3}^{-}$,现将
>HCO${\;}_{3}^{-}$,现将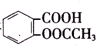 转变为
转变为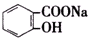 ,可行的方法是( )
,可行的方法是( )| A. | 向该溶液中加入足量的稀硫酸,加热 | |
| B. | 将该物质与稀硫酸共热后,再加入足量的NaOH溶液 | |
| C. | 将该物质与稀硫酸共热后,再加入足量的Na2CO3溶液 | |
| D. | 将该物质与足量的NaOH溶液共热,再通入足量CO2气体 |
 +2nH2O
+2nH2O