题目内容
4.下列化学方程式中,电子转移不正确的是( )| A. | 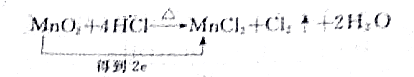 | |
| B. | 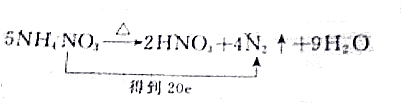 | |
| C. | 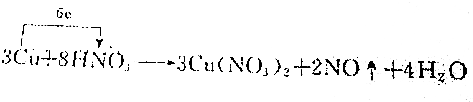 | |
| D. |  |
分析 在氧化还原反应中,元素化合价降低值=元素原子得电子的数目=元素化合价升高值=元素原子失电子的数目=转移电子数,据此回答.
解答 解:A、Mn元素的化合价降低了2价,所以得电子数是2,故A正确;
N、反应中,化合价变化的是氮元素,在8个0价的N中,其中有3个是从+5价将来的,还有5个是从-3价升高来的,元素化合价降低值=元素原子得电子的数目=元素化合价升高值=元素原子失电子的数目=转移电子数=15,故B错误;
C、反应中Cu的化合价升高,N的化合价降低,所以Cu失电子给了N原子,转移电子为6,故C正确;
D、反应中6mol盐酸参加反应,其中5mol做还原剂,转移电子是5mol,-1价的Cl失电子给了+5价的Cl,故D正确.
故选B.
点评 本题考查学生氧化还原反应中,化合价变化和电子转移之间的关系知识,注意规律:元素化合价降低值=元素原子得电子的数目=元素化合价升高值=元素原子失电子的数目=转移电子数的应用是关键.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目
15.对反应SO2+I2+2H2O=H2SO4+2HI 中描述正确的是( )
| A. | 反应中的氧化剂是SO2,还原剂是I2 | |
| B. | 反应中SO2被氧化,I2被还原 | |
| C. | 反应中有1mol电子转移,就有0.5mol SO2被还原 | |
| D. | H2SO4既是氧化产物,又是还原产物 |
4.3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成.一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取.①分离出甲醇的操作是的蒸馏.②萃取用到的分液漏斗使用前需检查是否漏水并洗净,分液时有机层在分液漏斗的上填(“上”或“下”)层.
(2)分离得到的有机层依次用饱和NaHCO3溶液、少量蒸馏水进行洗涤.用饱和NaHCO3 溶液洗涤的目的是除去HCl;不用饱和Na2CO3洗涤的目的是酚羟基可以和碳酸钠反应.
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是dcab(填字母).
a.蒸馏除去乙醚 b.冷却结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥.

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 甲醇 | 64.7 | / | 0.7915 | 易溶于水 |
| 乙醚 | 34.5 | / | 0.7138 | 微溶于水 |
| 3,5-二甲氧基苯酚 | / | 33~36 | / | 易溶于甲醇、乙醚,微溶于水 |
(2)分离得到的有机层依次用饱和NaHCO3溶液、少量蒸馏水进行洗涤.用饱和NaHCO3 溶液洗涤的目的是除去HCl;不用饱和Na2CO3洗涤的目的是酚羟基可以和碳酸钠反应.
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是dcab(填字母).
a.蒸馏除去乙醚 b.冷却结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥.
2.下列物质混合后,不会发生离子反应的是( )
| A. | NaOH溶液和FeCl3溶液 | B. | Na2CO3溶液和稀硫酸 | ||
| C. | CuSO4溶液和Ba(OH)2溶液 | D. | Na2SO4溶液和MgCl2溶液 |
 ,H2O2在MnO2作催化剂条件下分解的反应方程式并标明电子转移的方向和数目:
,H2O2在MnO2作催化剂条件下分解的反应方程式并标明电子转移的方向和数目: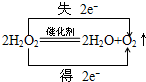 .
.