题目内容
4.3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成.一种以间苯三酚为原料的合成反应如下:
甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 甲醇 | 64.7 | / | 0.7915 | 易溶于水 |
| 乙醚 | 34.5 | / | 0.7138 | 微溶于水 |
| 3,5-二甲氧基苯酚 | / | 33~36 | / | 易溶于甲醇、乙醚,微溶于水 |
(2)分离得到的有机层依次用饱和NaHCO3溶液、少量蒸馏水进行洗涤.用饱和NaHCO3 溶液洗涤的目的是除去HCl;不用饱和Na2CO3洗涤的目的是酚羟基可以和碳酸钠反应.
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是dcab(填字母).
a.蒸馏除去乙醚 b.冷却结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥.
分析 本题是根据醇与醇之间可生成醚的原理,利用间三苯酚制3,5-二甲氧基苯酚的实验探究,涉及反应混合物的分离和提纯,主要考查的是蒸馏与分液操作,另外还探究了根据反应原理可能得到的副产品,据此可作答;
(1)沸点不同且互溶的液体可以采用蒸馏的方法分离,分液漏斗使用前要进行检漏,根据密度分析;
(2)碳酸氢钠能和强酸反应,苯酚的酸性大于HCO3-,能和碳酸钠溶液反应;
(3)粗产品中仍含有少量水及混有的乙醚,故需要除水干燥、蒸馏除乙醚,可根据各步骤实验目的进行排序.
解答 解:(1)①根据图表知,甲醇和乙醚的能互溶,但沸点不同,所以可以采用蒸馏的方法分离出甲醇,故答案为:蒸馏;
②分液漏斗在使用前要进行检漏,当分液漏斗不漏时才能使用,根据密度知,有机层的密度小于水,是在上方,故答案为:检查是否漏水;上;
(2)因为混合物中含有氯化氢,氯化氢能和碳酸氢钠反应,所以为除去氯化氢用饱和NaHCO3 溶液洗涤,酚羟基可以和碳酸钠溶液得到酚钠和碳酸氢钠,故答案为:除去HCl;酚羟基可以和碳酸钠反应;
(3)洗涤完成后,为除去水分,用无水氯化钙干燥,然后过滤除去干燥剂,再根据沸点不同利用蒸馏的方法除去乙醚,最后再利用重结晶的方法制得较纯产物,所以其排列顺序为:dcab,故答案为:dcab;
点评 本题考查了有机物的分离和提纯,对于减压蒸馏接触较少,学生感觉较难,为学习难点.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
6.下列关于Na2CO3和NaHCO3的说法中,不正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 常温下在水中的溶解度:Na2CO3>NaHCO3 | |
| C. | Na2CO3溶液和NaHCO3溶液可用澄清石灰水鉴别 | |
| D. | 相同物质的量Na2CO3和NaHCO3与盐酸完全反应,产生的CO2一样多,消耗HCl的物质的量之比为2:1 |
7.对于可逆反应:mA(g)+nB(g)?xC(g)+yD(s)△H=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如图所示,下列判断正确的是( )


| A. | △H>0,m+n>x+y | B. | △H<0,m+n>x+y | C. | △H<0,m+n>x | D. | △H>0,m+n<x |
4.下列化学方程式中,电子转移不正确的是( )
| A. | 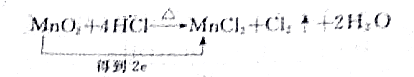 | |
| B. | 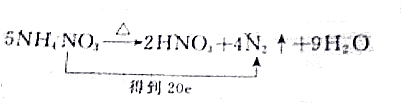 | |
| C. | 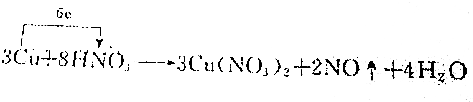 | |
| D. |  |
9.某化学小组以苯甲酸为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
Ⅰ合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约0.79g•mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)浓硫酸的作用是;催化剂、吸水剂简述混合液体时最后加入浓硫酸的理由:浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发.
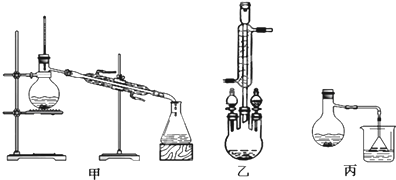
(2)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用装置乙(填“甲”或“乙”或“丙”).
Ⅱ粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅰ操作Ⅱ.
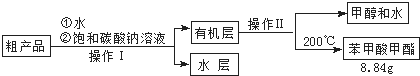
(4)能否用NaOH溶液代替饱和碳酸钠溶液?否(填“能”或“否”),并简述原因氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(5)通过计算,苯甲酸甲酯的产率是65%.
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约0.79g•mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)浓硫酸的作用是;催化剂、吸水剂简述混合液体时最后加入浓硫酸的理由:浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发.
(2)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用装置乙(填“甲”或“乙”或“丙”).

Ⅱ粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅰ操作Ⅱ.

(4)能否用NaOH溶液代替饱和碳酸钠溶液?否(填“能”或“否”),并简述原因氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(5)通过计算,苯甲酸甲酯的产率是65%.
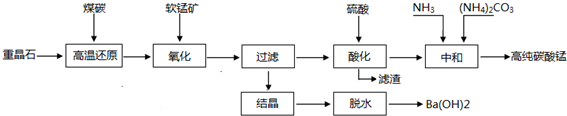
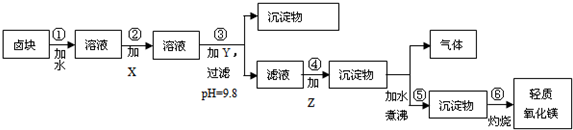
16.卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它以及表2中的某些物质为原料,按图所示工艺流程进行生产,可制得轻质氧化镁.
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
*Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去.
表2 原料价格表
(1)在步骤②中加入的试剂X,最佳的选择是漂液NaClO,写出步骤②中pH=1时所发生反应的离子方程式:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O;
(2)在步骤③中加入的试剂是烧碱;之所以要控制pH=9.8,其目的是使Mg2+以外的杂质离子转化成沉淀除去;
(3)某燃料电池的燃料为CO,氧化剂为含CO2的O2,电解质为熔融态的试剂Z(步骤④中加入试剂的有效成分),则该燃料电池的正极电极反应方程式为:O2+4e-+2CO2═2CO32-;
(4)在步骤⑤中发生的反应是MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Mg(OH)2+CO2↑.

若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6* |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
表2 原料价格表
| 物质 | 价格(元•吨-1) |
| 漂液(含25.2% NaClO) | 450 |
| 双氧水(含30% H2O2) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
(2)在步骤③中加入的试剂是烧碱;之所以要控制pH=9.8,其目的是使Mg2+以外的杂质离子转化成沉淀除去;
(3)某燃料电池的燃料为CO,氧化剂为含CO2的O2,电解质为熔融态的试剂Z(步骤④中加入试剂的有效成分),则该燃料电池的正极电极反应方程式为:O2+4e-+2CO2═2CO32-;
(4)在步骤⑤中发生的反应是MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Mg(OH)2+CO2↑.
14.下列物质的分类结果全部正确的是( )
| A. | 纯碱-碱 硫化氢-酸 小苏打-酸式盐 | |
| B. | 碘酒-混合物 胆矾-纯净物 臭氧-单质 | |
| C. | 葡萄糖-电解质 CO2-酸性氧化物 蛋白质溶液-胶体 | |
| D. | 氨水-电解质 硫酸钡-非电解质 酒精-有机物 |