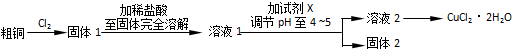题目内容
1.烟气脱硫能有效减少二氧化硫的排放.实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝溶液,并用于烟气脱硫.
(1)不能 (“能”或“不能”)用NaOH溶液代替H2SO4溶液.
(2)酸浸时反应的离子方程式为Al2O3+6H+═2Al3++3H2O.
(3)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸并使并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x.Al2(SO4)x(OH)6-2x易(填“易”或“难”)于水.
(4)已知粉煤灰中Al2O3的质量分数为40.8%,制得的碱式硫酸铝Al2(SO4)x(OH)6-2x中x=1.5.某实验小组取80.0g粉煤灰进行上述实验,假设在整个过程中铝的损耗率为10%,则可制得碱式硫酸铝的质量为71.72g.
分析 粉煤灰(主要含Al2O3、SiO2等)和稀硫酸混合,发生反应Al2O3+3H2SO4═Al2(SO4)3+3H2O,SiO2和稀硫酸不反应,过滤溶液得滤渣Ⅰ为SiO2,滤液中含有Al2(SO4)3,调节pH=3.6,加入CaCO3粉末,发生反应CaCO3+2H+═Ca2++CO2↑+H2O,CaSO4为微溶物,所以滤渣Ⅱ的成分主要为CaSO4,过滤得滤液Ⅱ,二氧化硫和水反应生成的SO32-易被氧化生成SO42-,弱酸根离子转化为强酸根离子,据此解答;
(1)氢氧化钠溶液既能和Al2O3反应,也能和SiO2反应;
(2)酸浸是利用硫酸溶解烟煤灰里的氧化铝,生成硫酸铝,反应的化学方程式为Al2O3+3H2SO4═Al2(SO4)3+3H2O,再改写为离子方程式;
(3)反应后的混合溶液显酸性,加入碳酸钙可中和酸,调节溶液的pH,促进Al2(SO4)3的水解,生成可溶的Al2(SO4)x(OH)6-2x;
(4)先根据混合物的质量分数计算出氧化铝的质量,再求出物质的量,根据铝原子守恒并结合利用率可计算出理论碱式硫酸铝的质量.
解答 解:(1)酸浸的目的是将粉煤灰中的氧化铝转化为可溶性铝盐,实现与其它成分的分离,如选用氢氧化钠溶液,则还能溶解二氧化硅,故不能用氢氧化钠溶液代替硫酸溶液,故答案为:不能;
(2)用硫酸溶解氧化铝的离子反应方程式为Al2O3+6H+═2Al3++3H2O,故答案为:Al2O3+6H+═2Al3++3H2O;
(3)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为易溶于水的Al2(SO4)x(OH)6-2x,故答案为:中和溶液中的酸并使并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x;易;
(4)80.0g粉煤灰中Al2O3的质量分数为40.8%,则氧化铝的质量为80.0g×40.8%=32.64g,其物质的量为$\frac{32.64g}{102g/mol}$=0.32mol,Al3+的物质的量为0.32mol×2=0.64mol,碱式硫酸铝Al2(SO4)x(OH)6-2x中x=1.5时的相对式量为27×2+96×1.5+17×3=249,根据铝原子守恒,理论得到的碱式硫酸铝的物质的量是0.64mol×(1-10%)÷2=0.288mol,质量为0.288mol×249g/mol=71.72g,故答案为:71.72.
点评 本题考查了物质的制备原理,明确物质的性质是解本题关键,会从整体上分析每一步发生的反应及基本操作,知道加入物质的用途,题目难度中等.

| A. | 2mol CO+0.5mol H2O(g)+1mol CO2+1mol H2 | |
| B. | 1.5mol CO+0.5mol H2O(g)+0.4mol CO2+0.4mol H2 | |
| C. | 1mol CO+1mol H2O(g)+1mol CO2+1mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2 |
| A. | 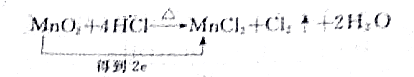 | |
| B. | 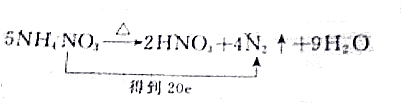 | |
| C. | 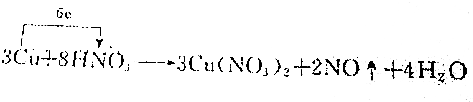 | |
| D. |  |
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
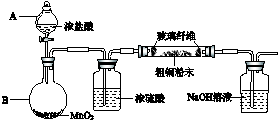
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约0.79g•mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)浓硫酸的作用是;催化剂、吸水剂简述混合液体时最后加入浓硫酸的理由:浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发.
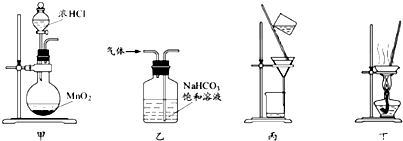
(2)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用装置乙(填“甲”或“乙”或“丙”).
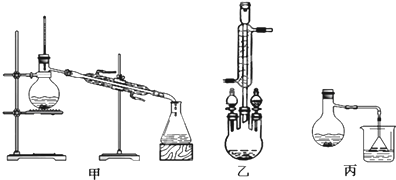
Ⅱ粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅰ操作Ⅱ.
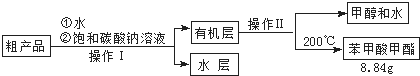
(4)能否用NaOH溶液代替饱和碳酸钠溶液?否(填“能”或“否”),并简述原因氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(5)通过计算,苯甲酸甲酯的产率是65%.
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6* |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
表2 原料价格表
| 物质 | 价格(元•吨-1) |
| 漂液(含25.2% NaClO) | 450 |
| 双氧水(含30% H2O2) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
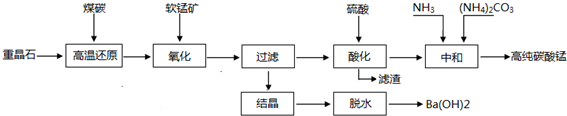
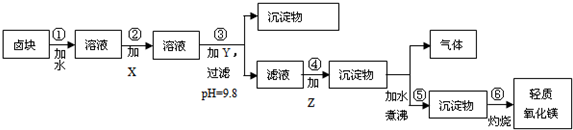
(2)在步骤③中加入的试剂是烧碱;之所以要控制pH=9.8,其目的是使Mg2+以外的杂质离子转化成沉淀除去;
(3)某燃料电池的燃料为CO,氧化剂为含CO2的O2,电解质为熔融态的试剂Z(步骤④中加入试剂的有效成分),则该燃料电池的正极电极反应方程式为:O2+4e-+2CO2═2CO32-;
(4)在步骤⑤中发生的反应是MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Mg(OH)2+CO2↑.

| A. | 点e的正反应速率比点d的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不同 | |
| D. | 在给定条件下,t1、t2时刻NH3的含量相同 |