题目内容
14.对某些化学反应,由于反应物用量不同,产物也会有所不同,试根据溶液中离子反应的初步知识,完成下列情况下的离子方程式.(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,写出发生反应的离子反应方程式2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O;
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,写出发生反应的离子方程式SO42-+Ba2+=BaSO4↓;
(3)向Ba(OH)2溶液中逐滴加入NaHSO4至恰好完全沉淀,写出反应的离子方程式H++SO42-+OH-+Ba2+=BaSO4↓+H2O;
(4)在(3)的溶液中,继续滴加NaHSO4溶液,写出发生反应的离子方程式H++OH-=H2O.
分析 (1)加入Ba(OH)2溶液至中性,生成硫酸钡、硫酸钠和水;
(2)继续滴加Ba(OH)2溶液,发生硫酸根离子与钡离子的反应;
(3)逐滴加入NaHSO4至恰好完全沉淀,生成硫酸钡、NaOH和水;
(4)在(3)的溶液中,继续滴加NaHSO4溶液,发生氢离子与氢氧根离子的反应.
解答 解:(1)加入Ba(OH)2溶液至中性,生成硫酸钡、硫酸钠和水,离子反应为2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O,
故答案为:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O;
(2)继续滴加Ba(OH)2溶液,发生硫酸根离子与钡离子的反应,离子反应为SO42-+Ba2+=BaSO4↓,故答案为:SO42-+Ba2+=BaSO4↓;
(3)逐滴加入NaHSO4至恰好完全沉淀,生成硫酸钡、NaOH和水,离子反应为H++SO42-+OH-+Ba2+=BaSO4↓+H2O,故答案为:H++SO42-+OH-+Ba2+=BaSO4↓+H2O;
(4)在(3)的溶液中,继续滴加NaHSO4溶液,发生氢离子与氢氧根离子的反应,离子反应为H++OH-=H2O,故答案为:H++OH-=H2O.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、与量有关的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
5.下列关于指定粒子的构成叙述中,正确的是( )
| A. | 37Cl与39K所含的中子数不同 | |
| B. | 12C和14C是不同的核素,但质子数相等 | |
| C. | H3O+与OH-的质子数和电子数均相同 | |
| D. | Mg2+与O2-的核外电子排布不相同 |
2.下列变化中需加入氧化剂才能实现的是( )
| A. | H2SO4→BaSO4 | B. | Fe3+→Fe2+ | C. | CuO→Cu | D. | Fe→Fe2+ |
9.某氧化剂中,起氧化作用的是X2O72-离子,在溶液中0.2mol该离子恰好能使0.6molSO32-离子完全氧化为SO42-,则X2O72-离子还原后的化合价为( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
6.下列关于Na2CO3和NaHCO3的说法中,不正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 常温下在水中的溶解度:Na2CO3>NaHCO3 | |
| C. | Na2CO3溶液和NaHCO3溶液可用澄清石灰水鉴别 | |
| D. | 相同物质的量Na2CO3和NaHCO3与盐酸完全反应,产生的CO2一样多,消耗HCl的物质的量之比为2:1 |
3.向某密闭容器中充入2molCO和1molH2O(g),发生反应:CO+H2O(g)=CO2+H2,当反应达到平衡时,CO的体积分数为W,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数小于W的是( )
| A. | 2mol CO+0.5mol H2O(g)+1mol CO2+1mol H2 | |
| B. | 1.5mol CO+0.5mol H2O(g)+0.4mol CO2+0.4mol H2 | |
| C. | 1mol CO+1mol H2O(g)+1mol CO2+1mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2 |
4.下列化学方程式中,电子转移不正确的是( )
| A. | 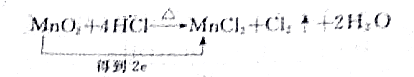 | |
| B. | 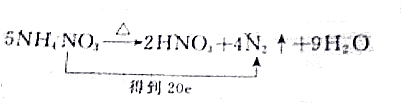 | |
| C. | 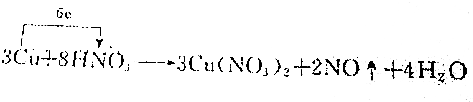 | |
| D. |  |
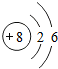 ;
;