题目内容
3. 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1mo N2(g)和1mo O2(g)完全反应放出的能量为180kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1mol N2(g)和1molO2(g)具有的总能量小于2molN(g)具有的总能量 | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
分析 A、分析能量变化黑球代表氧原子,依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算判断;
B、氮气和氧气在放电条件才能反应;
C、依据A计算的焓变判断反应能量变化,结合反应前后能量守恒分析;
D、一氧化氮不能和氢氧化钠反应.
解答 解:A、焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2═2NO,△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,反应是吸热反应,故A错误;
B、通常情况下,N2(g)和O2(g)混合不能直接生成NO,需要放电条件,故B错误;
C、由图中数据可得反应物键的断裂吸收(946+498)=1444kJ/mol的能量,生成物键的形成放出2×632=1264 kJ/mol的能量,故该反应是吸热反应,依据能量守恒,1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故C正确;
D、一氧化氮不能和氢氧化钠反应,不是酸性氧化物,故D错误;
故选:C.
点评 本题主要考查了反应能量变化的计算和判断,反应的焓变计算方法和能量守恒是解题关键,题目难度中等.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
13.由2-氯丙烷制取少量1,2-丙二醇时,需要经过下列哪几步反应( )
| A. | 加成→消去→取代 | B. | 消去→加成→消去 | C. | 消去→加成→取代 | D. | 取代→消去→加成 |
14.15L NO2和NO的混合气体通过水后收集到7L气体(同温同压),则被氧化的NO2体积( )
| A. | 4L | B. | 6L | C. | 8L | D. | 12L |
11.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 常温常压下,11.2L氯气含有的分之数为0.5NA | |
| B. | 常温常压下,1mol氮气含有的质子数为7NA | |
| C. | 在标准状态下,22.4LH2O含有的原子数目为3NA | |
| D. | 32gO2所含原子数目为2NA |
18.用下列气体和溶液进行喷泉实验,最终液体不能充满烧瓶的是( )
| A. | CO2和NaOH溶液 | B. | NO2和水 | C. | NH3和水 | D. | Cl2和NaOH溶液 |
8.对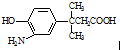 的表述不正确的是( )
的表述不正确的是( )
 的表述不正确的是( )
的表述不正确的是( )| A. | 该物质能发生缩聚反应 | |
| B. | 该物质有7种不同环境的氢原子 | |
| C. | 该物质遇FeCl3溶液显色,1mol该物质最多能与含1mol Br2的溴水发生取代反应 | |
| D. | 1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1 |
4.在25℃时,将0.2mol CH3COONa晶体和0.1mol HCl气体同时溶解于同一烧杯的水中,制得1L溶液,若此溶液中c(CH3COO-)>c(Cl-),则下列判断不正确的是( )
| A. | 该溶液的pH小于7 | B. | c(CH3COOH)+c(CH3COO-)=0.20 mol•L-1 | ||
| C. | c(CH3COO-)+c(OH-)=0.10 mol•L-1 | D. | c(CH3COOH)<c(CH3COO-) |
 测定产品纯度
测定产品纯度