题目内容
4.在25℃时,将0.2mol CH3COONa晶体和0.1mol HCl气体同时溶解于同一烧杯的水中,制得1L溶液,若此溶液中c(CH3COO-)>c(Cl-),则下列判断不正确的是( )| A. | 该溶液的pH小于7 | B. | c(CH3COOH)+c(CH3COO-)=0.20 mol•L-1 | ||
| C. | c(CH3COO-)+c(OH-)=0.10 mol•L-1 | D. | c(CH3COOH)<c(CH3COO-) |
分析 将0.2molCH3COONa晶体和0.1molHCl气体同时溶解于同一烧杯的水中,制得1L溶液,溶液中的溶质是醋酸钠和氯化钠、醋酸,且三者的物质的量浓度都是0.1mol/L,溶液中c(CH3COO-)>c(Cl-),则说明醋酸的电离程度大于醋酸根离子的水解程度.
解答 解:A.溶液中的溶质是醋酸钠和氯化钠、醋酸,且三者的物质的量浓度都是0.1mol/L,溶液中c(CH3COO-)>c(Cl-),则说明醋酸的电离程度大于醋酸根离子的水解程度,则溶液呈酸性,即溶液的pH小于7,故A正确;
B.根据物料守恒得c(CH3COOH)+c(CH3COO-)=0.20mol•L-1,故B正确;
C.溶液中根据物料守恒得c(CH3COOH)+c(CH3COO-)=0.20mol•L-1,且c(CH3COOH)<c(CH3COO-),所以c(CH3COO-)+c(OH-)>0.10mol•L-1,故C错误;
D.醋酸的电离程度大于醋酸根离子的水解程度,所以c(CH3COOH)<c(CH3COO-),故D正确;
故选C.
点评 本题考查离子浓度大小的比较,明确溶液中的溶质及其醋酸的电离程度大于醋酸根离子的水解程度是解本题关键,利用电荷守恒和物料守恒来分析解答,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3. 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1mo N2(g)和1mo O2(g)完全反应放出的能量为180kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1mol N2(g)和1molO2(g)具有的总能量小于2molN(g)具有的总能量 | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
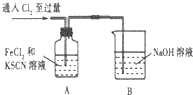
15.某学习小组对Cl2与FeCl2和KSCN混合溶液的反应进行探究.
(1)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(2)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(3)为探究现象2产生的原因,该小组进行如下实验:
①取A中黄色溶液少许于试管中,加入NaOH溶液,有红褐色沉淀生成,则原溶液中一定存在Fe3+.
②取A中黄色溶液少许于试管中,加入过量的KSCN溶液,最终得到红色溶液.该小组同学此得出结论:产生现象2的原因是SCN-与Cl2发生了反应.
(4)该小组同学猜想SCN-可能被Cl2氧化了,于是又进行了如下探究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是S元素.
②在实验中SCN-中氮元素被氧化为NO3-,检验NO3-存在的方法是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,则证明SCN-中氮元素被氧化为NO3-.
③已知SCN-中各原子均满足8电子稳定结构,试写出SCN-的电子式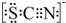 .
.
(5)若SCN-与Cl2反应生成1molCO2,则转移的电子数是16mol.
| 操作 | 现象 |
 | 1.A中溶液变红 2.稍后,A中溶液由红色变为黄色 |
(2)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(3)为探究现象2产生的原因,该小组进行如下实验:
①取A中黄色溶液少许于试管中,加入NaOH溶液,有红褐色沉淀生成,则原溶液中一定存在Fe3+.
②取A中黄色溶液少许于试管中,加入过量的KSCN溶液,最终得到红色溶液.该小组同学此得出结论:产生现象2的原因是SCN-与Cl2发生了反应.
(4)该小组同学猜想SCN-可能被Cl2氧化了,于是又进行了如下探究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是S元素.
②在实验中SCN-中氮元素被氧化为NO3-,检验NO3-存在的方法是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,则证明SCN-中氮元素被氧化为NO3-.
③已知SCN-中各原子均满足8电子稳定结构,试写出SCN-的电子式
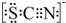 .
.(5)若SCN-与Cl2反应生成1molCO2,则转移的电子数是16mol.
12.通常用来衡量一个国家石油化工发展水平的标志是( )
| A. | 石油的产量 | B. | 乙烯的产量 | C. | 硫酸的产量 | D. | 合成纤维的产量 |
16.某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度.有关的叙述正确的是( )
| A. | H2Y的电离方程式为:H2Y+2H2O?2H3O++Y2- | |
| B. | 在该酸式盐溶液中c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解方程式为HY-+H2O?H3O++Y2- | |
| D. | 在该酸式盐溶液中c(Na+)>c(HY-)>c(OH-)>c(H+) |
13.某元素原子的最外层电子数是次外层电子数的3倍短周期元素,该元素为( )
| A. | 锂 | B. | 铍 | C. | 氧 | D. | 钙 |
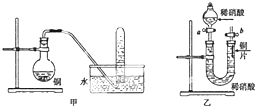 如图是甲、乙两位同学探究铜与稀硝酸.反应还原产物的实验装置图,请回答下列问题:
如图是甲、乙两位同学探究铜与稀硝酸.反应还原产物的实验装置图,请回答下列问题: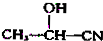 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$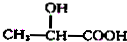
 $→_{②Zn/H_{2}O}^{①O}$
$→_{②Zn/H_{2}O}^{①O}$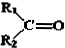 +
+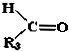
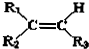
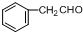 .现有如下转化关系:
.现有如下转化关系: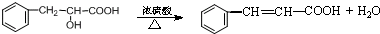 ;反应类型为消去反应;
;反应类型为消去反应;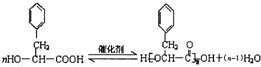 ;
;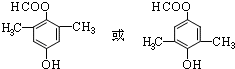 .
.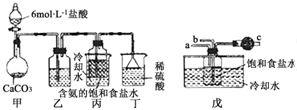 “侯氏制碱法”是我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得NaHCO3,进而生产纯碱的一种化工方法.有关的化学反应方程式如下:
“侯氏制碱法”是我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得NaHCO3,进而生产纯碱的一种化工方法.有关的化学反应方程式如下: