题目内容
13.由2-氯丙烷制取少量1,2-丙二醇时,需要经过下列哪几步反应( )| A. | 加成→消去→取代 | B. | 消去→加成→消去 | C. | 消去→加成→取代 | D. | 取代→消去→加成 |
分析 要生成1,2-丙二醇,需要引入2个羟基,据此可用逆推法判断:CH3CH(OH)CH2OH→CH3CHBrCH2Br→CH3CH=CH2→CH3CHClCH3,以此判断合成时所发生的反应类型.
解答 解:由2-氯丙烷制取少量的1,2-丙二醇,可用逆推法判断:CH3CH(OH)CH2OH→CH3CHBrCH2Br→CH3CH=CH2→CH3CHClCH3,则2-氯丙烷应首先发生消去反应生成CH3CH=CH2,CH3CH=CH2与溴发生加成反应生成CH3CHBrCH2Br,CH3CHBrCH2Br发生水解反应可生成1,2-丙二醇,水解反应即为取代反应,故选C.
点评 本题主要考查有机物合成、有机反应类型,题目难度不大,需要学生熟练掌握官能团的性质与转化.

练习册系列答案
相关题目
3.下列反应中,不属于加成反应的是( )
| A. | 乙炔与氯化氢反应制取氯乙烯 | B. | 乙烯使溴的四氯化碳溶液褪色 | ||
| C. | 乙醛与氢气反应生成乙醇 | D. | 苯与液溴在铁催化作用下反应 |
4.下列有关实验现象的描述不正确的是( )
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| B. | 用铜板做电极电解硫酸铜溶液,阴极铜板质量增加 | |
| C. | 把铜片插入氯化铁溶液中,加入几滴氯化铜溶液,气泡放出的速率加大 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出的速率加大 |
8.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)25℃下实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
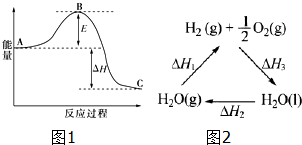
(2)合成氨反应:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),反应过程的能量变化如图1所示.已知N2(g)与H2(g)反应生成34gNH3(g),放出92.2kJ的热量.请回答下列问题:
该反应通常用铁作催化剂,加催化剂会使图中E变小(填“大”或“小”),图中△H=-46.1kJ/mol
(3)由气态基态原子形成1mol化学键释放的能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2(g)+3H2(g)═2NH3(g)△H=a kJ•mol-1.试根据表中所列键能数据估算a 的值:-93.
(4)已知:△H2=+44kJ•mol-1,△H3=-285.8kJ•mol-1图2列出它们之间的转变关系.请计算298K时由H2O(g)生成1molH2(g)和1/2molO2(g)反应的△H1=-(△H2+△H3)(用△H2、△H3表示△H1计算等式),+241.8kJ•mol-1(计算△H1数据结果).
(1)25℃下实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
(2)合成氨反应:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),反应过程的能量变化如图1所示.已知N2(g)与H2(g)反应生成34gNH3(g),放出92.2kJ的热量.请回答下列问题:
该反应通常用铁作催化剂,加催化剂会使图中E变小(填“大”或“小”),图中△H=-46.1kJ/mol
(3)由气态基态原子形成1mol化学键释放的能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
(4)已知:△H2=+44kJ•mol-1,△H3=-285.8kJ•mol-1图2列出它们之间的转变关系.请计算298K时由H2O(g)生成1molH2(g)和1/2molO2(g)反应的△H1=-(△H2+△H3)(用△H2、△H3表示△H1计算等式),+241.8kJ•mol-1(计算△H1数据结果).

18.已知有机物甲、乙、丙有如下信息:
据此推断:
(1)甲的分子式为C3H8,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有4种.
(2)乙是性能优良的环保产物,可代替某些破坏臭氧层的氟利昂产品用作制冷剂.其分子中C、H、F的原子个数之比为1:2:2,则乙的结构式为 .
.
(3)将甲、乙按物质的量之比1:1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,且丙分子不存在同分异构体,则丙的分子式为C2H5F.
| 甲 | 乙 | 丙 | |
| 所含元素 | C、H | C、H、F | C、H、F |
| 所含电子数 | 26 | ||
| 结构特点 | 饱和有机物 | ||
(1)甲的分子式为C3H8,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有4种.
(2)乙是性能优良的环保产物,可代替某些破坏臭氧层的氟利昂产品用作制冷剂.其分子中C、H、F的原子个数之比为1:2:2,则乙的结构式为
 .
.(3)将甲、乙按物质的量之比1:1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,且丙分子不存在同分异构体,则丙的分子式为C2H5F.
5.碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH.电池放电时,负极上发生反应的物质是( )
| A. | Zn | B. | 碳棒 | C. | MnO2 | D. | MnO2和H2O |
2.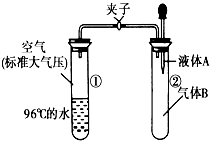 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 水、氨气 | ||
| C. | 氢氧化钠溶液、一氧化氮 | D. | 水、二氧化氮 |
3. 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1mo N2(g)和1mo O2(g)完全反应放出的能量为180kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1mol N2(g)和1molO2(g)具有的总能量小于2molN(g)具有的总能量 | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
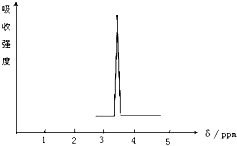 (1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).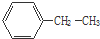 乙苯
乙苯