题目内容
15.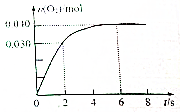 一定温度下,向2.0L恒容密闭容器中充入0.88mol NO2(g),发生反应:2NO2(g)?O2(g)+2NO(g),得到O2的物质的量随时间变化曲线如图所示,回答下列问题:
一定温度下,向2.0L恒容密闭容器中充入0.88mol NO2(g),发生反应:2NO2(g)?O2(g)+2NO(g),得到O2的物质的量随时间变化曲线如图所示,回答下列问题:(1)前2s内,v(NO)为0.060mol/(L•s)mol•L-1•s-1,该反应的平衡常数为0.0002mol/L;
(2)下列选项中,能说明该反应达到平衡状态的依据是bc.
a.v(NO2)=v(NO)
b.气体的颜色不再变化
c.混合气体平均相对分子质量不再改变
d.混合气体密度不变
(3)保持温度不变,向此容器中再通入1.2mol NO2和0.12mol NO,则平衡不移动(填“正向移动”、“逆向移动”或“不移动”,),其原因是因为Qc=K,反应仍是平衡状态;
(4)保持其他条件不变,①加入催化剂,NO2的转化率不变(填“增大”“减小”或“不变”),其原因是催化剂只能加快反应速率不影响平衡移动;②升高温度,平衡时c(O2)=0.022mol•L-1,则该反应的△H>0(填“>”、“<”或“=”).
分析 (1)据图求算v(O2),再据v(NO)=2v(O2)计算速率;据平衡时,n(O2)=0.040mol,可知各物质的浓度,据K=$\frac{[NO]^{2}•[{O}_{2}]}{[N{O}_{2}]^{2}}$计算;
(2)当可逆反应的正逆反应速率相等,各组分浓度保持不变时,反应达到平衡状态,据此分析;
(3)据Qc与K的大小比较;
(4)催化剂不影响平衡移动,只能加快反应速率;升温氧气浓度增大,说明平衡正向移动,正反应吸热.
解答 解:(1)v(O2)=$\frac{\frac{0.030mol}{2.0L}}{2s}$=0.030mol/(L•s),所以v(NO)=2×0.030mol/(L•s)=0.060mol/(L•s);平衡时c(O2)=$\frac{0.040mol}{2.0L}$=0.020mol/L,则平衡时c(NO)=0.040mol/L,则平衡时c(NO2)=$\frac{0.88mol}{2.0L}$-0.04mol/L=0.44mol/L-0.040mol/L=0.40mol/L,K=$\frac{[NO]^{2}•[{O}_{2}]}{[N{O}_{2}]^{2}}$=$\frac{0.04{0}^{2}×0.020}{0.4{0}^{2}}$=0.0002mol/L,
故答案为:0.060mol/(L•s);0.0002mol/L;
(2)a.v(NO2)=v(NO),不能说明正逆反应速率相等,故a错误;
b.气体的颜色不再变化,说明二氧化氮的浓度不变,反应达到平衡状态,故b正确;
c.该反应是反应前后气体物质的量不同的反应,混合气体平均相对分子质量不再改变,说明气体物质的量不变,反应达到平衡状态,故c正确;
d.混合气体质量始终不变,容器体积不变,所以混合气体密度始终不变,密度不变不能说明反应达到平衡状态,故d错误;
故答案为:bc;
(3)向此容器中再通入1.2mol NO2和0.12mol NO,则c(NO)=0.04mol/L+$\frac{0.12mol}{2L}$=0.1mol/L,c(NO2)=0.4mol/L+$\frac{1.2mol}{2L}$=1.0mol/L,所以Qc=$\frac{0.{1}^{2}×0.02}{1.{0}^{2}}$=0.0002mol/L=K,反应仍是平衡状态,平衡不移动,故答案为:不移动;因为Qc=K,反应仍是平衡状态;
(4)催化剂只能加快反应速率不影响平衡移动,反应物转化率不变;原平衡,c(O2)=0.020mol•L-1,升温氧气浓度增大,说明平衡正向移动,正反应吸热,△H>0,故答案为:不变;催化剂只能加快反应速率不影响平衡移动;>.
点评 本题考查了化学反应速率以及平衡常数的计算、化学平衡状态的判断、据Qc与K的大小比较判断平衡状态、催化剂对可逆反应的影响,题目难度不大.

 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案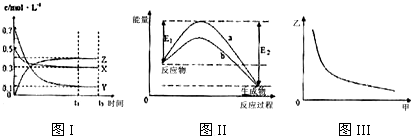
| A. | 该反应热化学方程式为X(g)+3Y(g)?2Z(g)△H=-(E2-E1)kJ•mol-1 | |
| B. | 若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 | |
| C. | 该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图II中曲线a是加入催化剂时的能量变化曲线,曲线b是没有加入催化剂时的能量变化曲线 |
| A. | 若Va=Vb,则混合后溶液PH=7 | |
| B. | 若Va<Vb,则混合后溶液PH一定大于7 | |
| C. | 若Va=Vb,则CH3COOH与NaOH完全中和 | |
| D. | 若Va=Vb,混合的溶液中微粒浓度关系可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
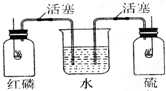 如图所示,红磷和硫磺在两纯氧集气瓶中燃烧,当火焰熄灭时,观察到的现象是( )
如图所示,红磷和硫磺在两纯氧集气瓶中燃烧,当火焰熄灭时,观察到的现象是( )| A. | 水迅速进入甲瓶和乙瓶 | B. | 水不进入甲瓶和乙瓶 | ||
| C. | 水只能进入甲瓶而不能进入乙瓶 | D. | 水只能进入乙瓶而不能进入甲瓶 |
| 容器编号 | 起始时各物质的物质的量/mol | 达平衡时能量的变化 | |||
| N2 | H2 | NH3 | Ar | ||
| ① | 1 | 3 | 0 | 0 | 放出热量Q1 |
| ② | 0.9 | 2.7 | 0.2 | 0 | 放出热量Q2 |
| ③ | 0.9 | 2.7 | 0.2 | 0.1 | 吸收热量Q3 |
| A. | 放出热量大小:Q1 >Q2 =Q3 | B. | 容器中的压强:③>①=2 | ||
| C. | N2的转化率:①<②<③ | D. | 平衡时NH3的体积分数:①=②<③ |
| 选项 | 实验操作 | 实验现象 | 绪论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液NO3-被Fe2+还原为NO2 |
| B | 溴乙烷中加入氢氧化钠溶液加热充分反应后,滴入硝酸银溶液 | 产生浅黄色沉淀 | 溴乙烷中含有溴元素 |
| C | 在0.1mol•L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 向含有硫酸钡沉淀的溶液加入浓碳酸钠溶液,充分搅拌后过滤、洗涤,在滤渣中加入盐酸 | 产生无色无味气体 | Ksp(BaSO4)>Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
| A. | HI的生成速率等于其分解速率 | |
| B. | HI的生成速率小于其分解速率 | |
| C. | HI的生成速率大于其分解速率 | |
| D. | 无法判断HI的生成速率和分解速率的相对大小 |
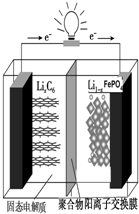 磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4
磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4