题目内容
6.配制250毫升,密度为1.1g/ml,1mol/L的稀盐酸,需用37%,密度为1.19g/ml的浓盐酸多少毫升?需加水多少克(毫升)?分析 根据c=$\frac{1000ρω}{M}$计算37%,密度为1.19g/ml该浓盐酸的物质的量浓度;根据稀释定律:稀释前后HCl的物质的量相等计算需要浓盐酸的体积.根据m=ρv计算需加水多少克.
解答 解:根据c=$\frac{1000ρω}{M}$可知,该浓盐酸的物质的量浓度为$\frac{1000×1.19×37%}{36.5}$mol/L≈12mol/L,设需要浓盐酸的体积为V,根据稀释定律,稀释前后HCl的物质的量相等,则:V×12mol/L=250mL×1mol/L,解得V≈20.83mL,250毫升,密度为1.1g/ml,1mol/L的稀盐酸溶液的质量为m=ρv=1.1g/ml×250毫升=275g,37%,密度为1.19g/ml的浓盐酸20.83mL的质量为m=ρv=1.19g/ml×20.83mL≈25g,需加水275g-25g=250g,水的密度为1g/cm3,所以需加水250克(毫升),
答:需用37%,密度为1.19g/ml的浓盐酸20.83mL;需加水250克(毫升).
点评 本题考查溶液浓度有关计算,涉及物质的量浓度、质量分数计算,注意理解掌握物质的量浓度与质量分数之间的关系是解答关键,题目难度不大.

练习册系列答案
相关题目
16.原子序数11~17号的元素,随着核电荷数的递增而逐渐变小的是( )
| A. | 电子层数 | B. | 原子半径 | ||
| C. | 原子的最外层电子数 | D. | 元素最高化合价 |
17.某化合物受热可完全分解,其中一种气体可使润湿的红色石蕊试纸变蓝,另一气体可澄清石灰水变浑浊.取该化合物溶于水,加入CaCl2溶液,无现象.则该化合物可能是( )
| A. | NH4HCO3 | B. | NH4Cl | C. | NH4NO3 | D. | (NH4)2CO3 |
1.下列有关反应热测定实验叙述正确的是( )
| A. | 盖斯定律为我们提供了解决很难由实验直接测定而获得反应热的理论依据 | |
| B. | 若用50mL 0.50mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.25mo1•L-1的硫酸充分反应,两反应测定的反应热不相等 | |
| C. | 实验时只需要记录反应体系的最高温度t即可 | |
| D. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,再用环形玻璃搅拌棒不断搅拌 |
11.下列化学用语正确的是( )
| A. | Cl-的结构示意图: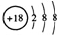 | |
| B. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| C. | 光导纤维主要成分的化学式:Si | |
| D. | H216O、D216O、H218O、D218O互为同位素 |
15.以下试剂不能鉴别H2S和SO2的是( )
| A. | NaOH溶液 | B. | 滴有淀粉的碘水 | C. | CuSO4溶液 | D. | 品红溶液 |
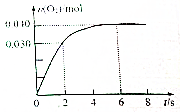 一定温度下,向2.0L恒容密闭容器中充入0.88mol NO2(g),发生反应:2NO2(g)?O2(g)+2NO(g),得到O2的物质的量随时间变化曲线如图所示,回答下列问题:
一定温度下,向2.0L恒容密闭容器中充入0.88mol NO2(g),发生反应:2NO2(g)?O2(g)+2NO(g),得到O2的物质的量随时间变化曲线如图所示,回答下列问题: