题目内容
4.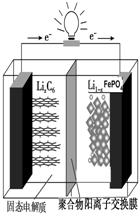 磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4
磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4(1)磷酸铁锂电池放电时,正极反应式为Li(1-x)FePO4+xLi++xe-═LiFePO4.
(2)若用该电池电解精炼铜,阴极质量增重19.2g时,则电池中通过聚合物隔膜的Li+数目为0.6NA.
(3)以该电池为电源,用Fe2O3为阳极,石墨为阴极,NaOH溶液为电解质溶液制备高铁酸钠(Na2FeO4),写出阳极的电极反应式Fe2O3-6e-+10OH-═2FeO42-+5H2O.
(4)学生在实验时若被白磷(以P表示)灼伤,可用硫酸铜溶液涂抹伤处,有铜和H3PO4生成,写出此反应的化学方程式2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4.
(5)一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=8.4×10-36mol2•L-2;H2S:Ka1=1.2×10-7mol•L-1,Ka2=7×10-15mol•L-1
①通过计算说明反应CuS(s)+2H+?Cu2++H2S进行的程度此反应K﹦1×10-14<10-5,所以反应难以进行.
②常温下,NaHS溶液呈碱性,此溶液中离子浓度由小到大的顺序是c(S2-)<c(H+)<c(OH-)<c(HS-)<c(Na+).若向此溶液中加入硫酸铜溶液,恰好完全反应,所得溶液pH<7(填“>”“<”或“﹦”),其原因是HS-+Cu2+═CuS↓+H+(用离子方程式表示).
分析 (1)放电时,Li1-xFePO4在正极上得电子发生还原反应;
(2)若用该电池电解精炼铜,依据串联电路中各个电极转移电子数相同,依据Cu2++2e-=Cu,计算转移电子数;
(3)用Fe2O3为阳极,石墨为阴极,NaOH溶液为电解质溶液,阳极三氧化二铁失去电子发生氧化反应结合氢氧根离子生成高铁酸根离子;
(4)依据题干给出产物,结合得失电子守恒、原子个数守恒写成方程式;
(5)①计算CuS(s)+2H+?Cu2++H2S的K值,依据一个反应的平衡常数小于10-5,则认为这个反应很难进行,进行判断;
②常温下,NaHS溶液呈碱性,说明硫氢根离子水解程度大于电离,据此解答;
③依据铜离子与硫氢根离子发生反应HS-+Cu2+CuS↓+H+,解答.
解答 解:(1)放电时,Li(1-x)FePO4在正极上得电子,其正极反应为:Li(1-x)FePO4+xLi++x e-═LiFePO4;
故答案为:Li(1-x)FePO4+xLi++x e-═LiFePO4;
(2)电解精炼铜,阴极电极反应为:Cu2++2e-=Cu,每转移2mol电子,析出64g铜,所以阴极质量增重19.2g时,转移电子数为:$\frac{19.2g}{64g/mol}$×2=0.6mol,电池与电解池为串联,所以当电解池中转移0.6mol电子,电池中转移电子数为0.6mol,锂离子带1个单位正电荷,则电池中通过聚合物隔膜的Li+数目为0.6NA;
故答案为:0.6NA;
(3)用Fe2O3为阳极,石墨为阴极,NaOH溶液为电解质溶液制备高铁酸钠(Na2FeO4),阳极三氧化二铁失去电子发生氧化反应结合氢氧根离子生成高铁酸根离子,电极反应式为:Fe2O3-6e-+10OH-═2FeO42-+5H2O;
故答案为:Fe2O3-6e-+10OH-═2FeO42-+5H2O;
(4)磷与硫酸铜溶液反应生成产物铜、磷酸,依据原子个数守恒可知还会生成硫酸,反应中铜由+2价降低到0价,P由0价升高到+5价,依据得失电子守恒,硫酸铜系数为5,磷的系数为2,依据原子个数守恒,该反应的方程式:2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4;
故答案为:2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4;
(5)①Ksp=[Cu2+][S2-];H2S:Ka1=$\frac{[{H}^{+}][H{S}^{-}]}{[{H}_{2}S]}$;Ka2=$\frac{[{H}^{+}][{{S}^{2}}^{-}]}{[H{S}^{-}]}$;
CuS(s)+2H+?Cu2++H2S,反应的K=$\frac{[C{{u}^{2}}^{+}][{H}_{2}S]}{[{H}^{+}]^{2}}$=Ksp÷Ka2÷Ka1=8.4×10-36mol2•L-2÷1.2×10-7mol•L-1÷7×10-15mol•L-1=1×10-14<10-5,所以反应难以进行;
故答案为:此反应K﹦1×10-14<10-5,所以反应难以进行;
②硫氢化钠为强电解质,完全电离生成钠离子与硫氢根离子,硫氢根离子部分发生水解,部分发生电离,所以钠离子浓度大于硫氢根离子浓度,因为常温下,NaHS溶液呈碱性说明硫氢根离子水解程度大于电离程度,所以氢氧根离子浓度大于硫离子浓度,加之水电离生成氢离子,所以氢离子浓度大于硫离子浓度,所以离子浓度大小顺序为:c(S2-)<c(H+)<c(OH-)<c(HS-)<c(Na+);
向溶液中加入硫酸铜后发生反应:HS-+Cu2+CuS↓+H+,生成氢离子,所以溶液pH<7;
故答案为:c(S2-)<c(H+)<c(OH-)<c(HS-)<c(Na+);<;HS-+Cu2+═CuS↓+H+.
点评 本题考查了原电池、电解池工作原理及相关计算,弱电解质电离平衡、沉淀溶解平衡,熟悉原电池、电解池工作原理及各个电极发生反应、明确化学平衡常数的表达式是解题关键,题目难度中等.

 走进文言文系列答案
走进文言文系列答案| A. | NaOH溶液 | B. | 滴有淀粉的碘水 | C. | CuSO4溶液 | D. | 品红溶液 |
| A. | -1 | B. | +3 | C. | +5 | D. | +7 |
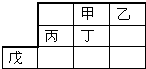
| A. | 最高价氧化物水化物的酸性:乙>丁 | |
| B. | 甲的一种单质是自然界最硬的物质 | |
| C. | 戊元素位于第4周期第 VⅢ族 | |
| D. | 乙、丙的最高价氧化物的水化物可以反应 |
| A. | Ba2+对人体无害,可用BaSO4做钡餐造影剂 | |
| B. | 海水提镁和海水提溴都涉及氧化还原反应 | |
| C. | 大量燃烧含硫的化石燃料是形成酸雨的主要原因 | |
| D. | 航天飞机上的陶瓷防护片属于新型无机非金属材料 |
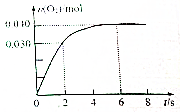 一定温度下,向2.0L恒容密闭容器中充入0.88mol NO2(g),发生反应:2NO2(g)?O2(g)+2NO(g),得到O2的物质的量随时间变化曲线如图所示,回答下列问题:
一定温度下,向2.0L恒容密闭容器中充入0.88mol NO2(g),发生反应:2NO2(g)?O2(g)+2NO(g),得到O2的物质的量随时间变化曲线如图所示,回答下列问题:

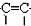 -$\stackrel{Pd}{→}$R-
-$\stackrel{Pd}{→}$R- ;
; ;
;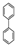 ),在一定条件下能发生银镜反应,且1molE最多可消耗4molNaOH
),在一定条件下能发生银镜反应,且1molE最多可消耗4molNaOH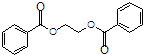 的流程,无机物任选,注明反应条件. 示例如下:A$→_{反应条件}^{反应物}$B$→_{反应条件}^{反应物}$.
的流程,无机物任选,注明反应条件. 示例如下:A$→_{反应条件}^{反应物}$B$→_{反应条件}^{反应物}$.