题目内容
3.25℃,将Va mL,PH=2的CH3COOH溶液与Vb mL PH=12的NaOH溶液混合,下列说法正确的是( )| A. | 若Va=Vb,则混合后溶液PH=7 | |
| B. | 若Va<Vb,则混合后溶液PH一定大于7 | |
| C. | 若Va=Vb,则CH3COOH与NaOH完全中和 | |
| D. | 若Va=Vb,混合的溶液中微粒浓度关系可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
分析 醋酸是弱电解质,在水中部分电离,当醋酸的pH=2时,醋酸溶液的物质的量浓度大于0.01 mol/L;pH=12的NaOH溶液中,c(NaOH)=0.01mol/L,
A.若Va=Vb,醋酸的浓度大于0.01mol/L,则浓度醋酸过量,混合液显示酸性;
B.若Va<Vb,由于醋酸的浓度大于氢氧化钠,则混合液不一定显示碱性;
C.若Va=Vb,醋酸过量,氢氧化钠不足;
D.若Va=Vb,混合液显示酸性,则c(H+)>c(OH-),根据电荷守恒可得:c(CH3COO-)>c(Na+),据此判断各离子浓度大小.
解答 解:醋酸是弱电解质,在水中部分电离,当醋酸的pH=a时,醋酸溶液的物质的量浓度大于0.01 mol/L;pH=12的NaOH溶液中,c(NaOH)=0.01mol/L,
A.若Va=Vb,醋酸的浓度大于0.01mol/L,则浓度醋酸过量,混合液显示酸性,溶液的pH<7,故A错误;
B.若Va<Vb,由于醋酸的浓度大于氢氧化钠,则混合液不一定显示碱性,即:混合液的pH不一定大于7,故B错误;
C.若Va=Vb,醋酸过量,氢氧化钠不足,醋酸没有完全反应,故C错误;
D.若Va=Vb,混合液显示酸性,则c(H+)>c(OH-),根据电荷守恒可得:c(CH3COO-)>c(Na+),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查了溶液离子浓度的大小比较,题目难度中等,做题时需要明确pH=12的NaOH溶液与pH=2的CH3COOH溶掖等体积混合后,溶液中醋酸过量,溶液呈酸性,为易错点.

练习册系列答案
相关题目
11.下列化学用语正确的是( )
| A. | Cl-的结构示意图: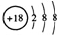 | |
| B. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| C. | 光导纤维主要成分的化学式:Si | |
| D. | H216O、D216O、H218O、D218O互为同位素 |
8.已知C3N4晶体可能具有比金刚石还大的硬度,且原子间均以单键结合,下列关于C3N4晶体的说法正确的是( )
| A. | C3N4是分子晶体 | |
| B. | C3N4晶体中微粒通过离子键结合 | |
| C. | C3N4晶体具有导电性和延展性 | |
| D. | C3N4晶体是以C、N原子为基本微粒,共价键为作用力的空间网状结构 |
11.下列说法正确的是( )
| A. | “地沟油”禁止食用,但可用来制肥皂 | |
| B. | 糖类、蛋白质、油脂属于天然高分子化合物 | |
| C. | 医疗中常用酒精來消毒,是因为酒精能使细菌蛋白质发生变性 | |
| D. | 氨基酸既能和强酸反应,又能和强碱反应 |
12.氯酸钾(KClO3)中氯元素的化合价为( )
| A. | -1 | B. | +3 | C. | +5 | D. | +7 |
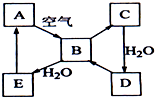 如图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.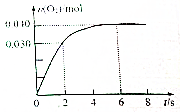 一定温度下,向2.0L恒容密闭容器中充入0.88mol NO2(g),发生反应:2NO2(g)?O2(g)+2NO(g),得到O2的物质的量随时间变化曲线如图所示,回答下列问题:
一定温度下,向2.0L恒容密闭容器中充入0.88mol NO2(g),发生反应:2NO2(g)?O2(g)+2NO(g),得到O2的物质的量随时间变化曲线如图所示,回答下列问题: