题目内容
20.相同温度下,容积相同的3个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.6-1.实验侧得起始、平衡时的有关数据如表:| 容器编号 | 起始时各物质的物质的量/mol | 达平衡时能量的变化 | |||
| N2 | H2 | NH3 | Ar | ||
| ① | 1 | 3 | 0 | 0 | 放出热量Q1 |
| ② | 0.9 | 2.7 | 0.2 | 0 | 放出热量Q2 |
| ③ | 0.9 | 2.7 | 0.2 | 0.1 | 吸收热量Q3 |
| A. | 放出热量大小:Q1 >Q2 =Q3 | B. | 容器中的压强:③>①=2 | ||
| C. | N2的转化率:①<②<③ | D. | 平衡时NH3的体积分数:①=②<③ |
分析 ②③中,将生成物完全转化为反应物后,氮气与氢气物质的量与①相同,都是1mol氮气3mol氢气,氨气0mol,容器体积不变,中③充入Ar气,对平衡移动无影响,所以①②③属于等效平衡,合成氨是放热反应,参加反应的氮气和氢气越多,反应放热越多,①中反应物比②③多,所以正向反应程度大,放热比②③多;平衡后①②③中氮气、氢气、氨气物质的量相同,但③中有Ar气,所以③压强大;①②③属于等效平衡,①反应物多,转化率大,②③转化率相同,各组分平衡体积分数相同,据此分析.
解答 解:A、②中含有0.2molNH3相当在①的基础上加入氨气,抑制平衡正向移动,则平衡时放出的热量小于Q1,③中在②的基础上加入Ar气,容器体积不变,充入Ar对平衡无影响,所以Q2=Q3,所以Q1 >Q2 =Q3,故A正确;
B、容器体积不变,①②③三平衡等效,③中充入了Ar气,压强较大,所以容器中压强③>①=②,故B正确;
C、①②③三平衡等效,②③加入反应物相同且少于①,所以氮气的转化率①>②=③,故C错误;
D、①②③三平衡等效,所以平衡时NH3的体积分数:①=②=③,故D错误;
故选AB.
点评 本题考查化学平衡移动问题,题目难度中等,注意从等效平衡的角度分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列现象或事实可用同一原理解释的是( )
| A. | 氯水和二氧化硫使品红溶液褪色 | |
| B. | 稀硝酸和三氯化铁溶液使KI-淀粉试纸变蓝 | |
| C. | 亚硫酸钠和水玻璃长期暴露在空气中变质 | |
| D. | 浓盐酸和浓硫酸长期暴露在空气中浓度变小 |
11.下列化学用语正确的是( )
| A. | Cl-的结构示意图: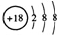 | |
| B. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| C. | 光导纤维主要成分的化学式:Si | |
| D. | H216O、D216O、H218O、D218O互为同位素 |
8.已知C3N4晶体可能具有比金刚石还大的硬度,且原子间均以单键结合,下列关于C3N4晶体的说法正确的是( )
| A. | C3N4是分子晶体 | |
| B. | C3N4晶体中微粒通过离子键结合 | |
| C. | C3N4晶体具有导电性和延展性 | |
| D. | C3N4晶体是以C、N原子为基本微粒,共价键为作用力的空间网状结构 |
4.下列离子方程式正确的是( )
| A. | 将SO2气体通入NaClO溶液中:SO2+ClO-+H2O=SO32-+2HClO | |
| B. | 向FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 三氯化铝溶液与足量的氨水反应:Al3++4OH-=[Al(OH)4]- | |
| D. | 用三氯化铁溶液腐蚀铜印刷电路板:2Fe3++Cu=Cu2++2Fe2+ |
11.下列说法正确的是( )
| A. | “地沟油”禁止食用,但可用来制肥皂 | |
| B. | 糖类、蛋白质、油脂属于天然高分子化合物 | |
| C. | 医疗中常用酒精來消毒,是因为酒精能使细菌蛋白质发生变性 | |
| D. | 氨基酸既能和强酸反应,又能和强碱反应 |
8.电渗析法是一种利用离子交换膜进行海水淡化的方法,工作原理如图所示.下列有关说法错误的是( )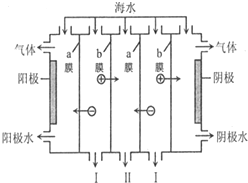

| A. | 阳极可发生电极反应:2Cl--2e-═Cl2↑ | |
| B. | 阴极附近溶液的pH减小 | |
| C. | a膜为阴离子交换膜,b膜为阳离子交换膜 | |
| D. | I、II分别是淡水、浓海水出口 |
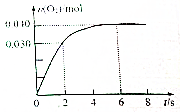 一定温度下,向2.0L恒容密闭容器中充入0.88mol NO2(g),发生反应:2NO2(g)?O2(g)+2NO(g),得到O2的物质的量随时间变化曲线如图所示,回答下列问题:
一定温度下,向2.0L恒容密闭容器中充入0.88mol NO2(g),发生反应:2NO2(g)?O2(g)+2NO(g),得到O2的物质的量随时间变化曲线如图所示,回答下列问题: