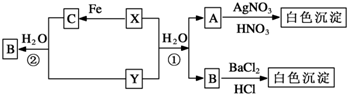
题目内容
17.可逆反应:2NO(g)+O2(g)═2NO2(g),在体积不变的密闭容器中反应,一定达到平衡状态的标志是( )| A. | 单位时间内生成n mol O2的同时生成n mol NO2 | |
| B. | 混合气体的颜色不再改变的状态 | |
| C. | ν(NO2):ν(NO):ν(O2)=2:2:1的状态 | |
| D. | 混合气体的密度不再改变的状态 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、量之比不等于计量数之比,所以不是平衡状态,故A错误;
B、混合气体的颜色不再变,说明二氧化氮的浓度不变,说明达平衡状态,故B正确;
C、只要反应发生就符合ν(NO2):ν(NO):ν(O2)=2:2:1的状态,故C错误;
D、混合气体的密度始终不变,所以不能作平衡状态的标志,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
2.下面的排序不正确的是( )
| A. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| B. | 沸点:CH4>SiH4>GeH4>SnH4 | |
| C. | 熔点由高到低:Al>Mg>Na | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
9.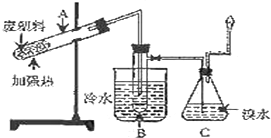 某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.
某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.
该研究小组在实验中测得加热聚丙烯废塑料所得的产物如下表:
(1)废塑料充分加热后,试管A中的残余物有多种用途,如可通过下列转化制取高聚物聚乙炔:
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$乙炔$\stackrel{③}{→}$聚乙炔该转化流程中,第②步反应的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑.
(2)试管B中收集到油状液体,其中的一种成分D能使酸性高锰酸钾溶液褪色.D与氯气在光照条件下生成一氯取代物的化学方程式为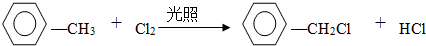 .
.
(3)锥形瓶C中的现象是有气泡,溶液颜色渐渐褪去,气体经过锥形瓶C中的溴水充分吸收后再经干燥,所得气体的平均相对分子质量为4.8.
(4)C中逸出的气体在工业上可用作(至少两点)可做燃料、做化工生产原料.
 某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.
某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.该研究小组在实验中测得加热聚丙烯废塑料所得的产物如下表:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$乙炔$\stackrel{③}{→}$聚乙炔该转化流程中,第②步反应的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑.
(2)试管B中收集到油状液体,其中的一种成分D能使酸性高锰酸钾溶液褪色.D与氯气在光照条件下生成一氯取代物的化学方程式为
 .
.(3)锥形瓶C中的现象是有气泡,溶液颜色渐渐褪去,气体经过锥形瓶C中的溴水充分吸收后再经干燥,所得气体的平均相对分子质量为4.8.
(4)C中逸出的气体在工业上可用作(至少两点)可做燃料、做化工生产原料.
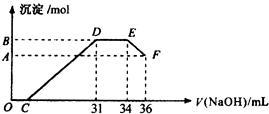 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低(如生成NO、N2O、N2、NH4+等).现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.则
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低(如生成NO、N2O、N2、NH4+等).现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.则 请按要求回答下列问题:
请按要求回答下列问题: 实验室制备乙酸乙酯,回答有关问题:
实验室制备乙酸乙酯,回答有关问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.