题目内容
2.下面的排序不正确的是( )| A. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| B. | 沸点:CH4>SiH4>GeH4>SnH4 | |
| C. | 熔点由高到低:Al>Mg>Na | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
分析 A.原子晶体中化学键键能越大、键长越短其硬度越大;
B.氢化物熔沸点与其相对分子质量成正比,含有氢键的氢化物熔沸点较高;
C.金属单质熔沸点与其金属键成正比,金属键与半径成反比,与电荷成正比;
D.晶格能与离子半径成反比,与电荷成正比.
解答 解:A.原子晶体中化学键键能越大、键长越短其硬度越大,这几种物质都是原子晶体,键长C-C<C-Si<Si-Si,所以硬度:金刚石>碳化硅>晶体硅,故A正确;
B.氢化物熔沸点与其相对分子质量成正比,这几种氢化物都不含氢键,所以熔沸点CH4<SiH4<GeH4<SnH4,故B错误;
C.Na、Mg、Al原子半径依次减小,金属离子电荷逐渐增多,金属键逐渐增强,则熔点由高到低:Al>Mg>Na,故C正确;
D.晶格能与离子半径成反比,与电荷成正比,离子半径,F-<Cl-<Br-<I-,则晶格能NaF>NaCl>NaBr>NaI,故D正确;
故选B.
点评 本题考查晶体熔沸点高低判断,侧重考查晶体类型判断及晶体熔沸点高低影响因素,注意晶格能、金属键与离子半径、离子所带电荷关系,题目难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
10.现有一块生锈的铁片,在进行铁与Cu(NO3)2溶液的置换实验之前需要对铁片进行预处理,下列处理方式不可行的是( )
| A. | 用稀硝酸处理铁片 | B. | 用稀盐酸处理铁片 | ||
| C. | 用浓硝酸处理铁片 | D. | 用浓盐酸处理铁片 |
17.可逆反应:2NO(g)+O2(g)═2NO2(g),在体积不变的密闭容器中反应,一定达到平衡状态的标志是( )
| A. | 单位时间内生成n mol O2的同时生成n mol NO2 | |
| B. | 混合气体的颜色不再改变的状态 | |
| C. | ν(NO2):ν(NO):ν(O2)=2:2:1的状态 | |
| D. | 混合气体的密度不再改变的状态 |
14.某无色透明的强酸性溶液中,能大量共存的一组离子是( )
| A. | Al3+、SO42-、Cl- | B. | Na+、AlO2- K+、SO42- | ||
| C. | MnO${\;}_{4}^{-}$、K+、SO42-、Na+ | D. | NH4+、NO3-、Fe2+、Cl- |
11.有机物甲能发生银镜反应,甲催化加氢还原成有机物乙,1mol乙跟足量的金属钠反应放出标准状况下氢气22.4L,据此推断乙一定不是( )
| A. | HOCH2CH2OH | B. | HOCH2CH(OH)CH3 | C. | CH3CH2CH2OH | D. | CH3CH(OH)CH(OH)CH3 |

 ⑥
⑥
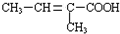 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
 中任意两种.
中任意两种.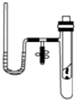 某研究性学习小组在探究化学反应中的能量变化时设计了如图所示的实验装置.
某研究性学习小组在探究化学反应中的能量变化时设计了如图所示的实验装置.
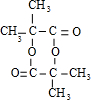 .
.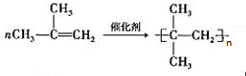 ;
;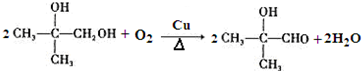 .
.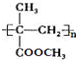 )的合成路线为
)的合成路线为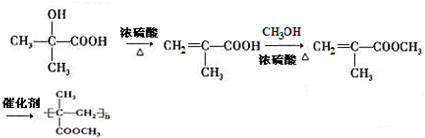 .
.