题目内容
12. 请按要求回答下列问题:
请按要求回答下列问题:(1)新出土的青铜器若保存不善,在潮湿的环境中容易生成铜绿,该腐蚀过程中的负极反应式为:Cu-2e-=Cu2+.
(2)在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式),生成该沉淀的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20).
(3)在25℃下,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应完成后溶液中c(NH4+)=c(Cl-),则溶液显中性(填“酸”“碱”或“中”),a>0.01mol•L-1(填“>”、“=”或“<”).
(4)已知在101kPa、273K时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是C.
A.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l)△H=+2akJ/mol
B.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(g)△H=-2akJ/mol
C.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-4akJ/mol
D.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H=-4akJ/mol
(5)如图是一个化学过程的示意图.
已知甲池的总反应式为:2CH3OH+3O2+4KOH?2K2CO3+6H2O
①请回答下列电极的名称:B(石墨)电极的名称是阳极.
②写出电极反应式:
通入O2的电极的电极反应式是O2+2H2O+4e-=4OH-.
A(Pt)电极的电极反应式为4Ag++4e-=4Ag,
③乙池中反应的化学方程式为4AgNO4+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
分析 (1)腐蚀过程中负极铜失去电子生成铁离子;
(2)难溶电解质的溶度积越小,加入氨水时越易生成沉淀;
(3)根据溶液中阴阳离子的电荷相等判断溶液的酸碱性;体积相等稀盐酸和氨水混合,若浓度相等,则恰好完全反应生成氯化铵,溶液显酸性,若溶液恰好呈中性时氨水应稍微过量;
(4)计算出乙烷的物质的量,然后计算出1mol乙烷、2mol乙烷完全燃烧放出热量,然后根据生成的水必须为液体、反应为放热角度进行判断;
(5)①根据方程式及燃料电池的特点判断甲装置;根据甲装置判断乙装置;根据外加电源名称确定乙装置石墨电极名称;
②先判断原电池、电解池的电极名称,再写出相应的电极反应式;
③乙池中电解硝酸银溶液生成银、氧气和硝酸,据此写出反应的化学方程式.
解答 解:(1)腐蚀过程中铜作为负极失去电子,电极式为:Cu-2e-=Cu2+,
故答案为:Cu-2e-=Cu2+;
(2)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,25℃时Ksp[Mg(OH)2]=1.8×10-11>Ksp[Cu(OH)2]=2.2×10-20,则优先生成的沉淀为Cu(OH)2,反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;
(3)根据溶液的电中性原则,c(NH4+)=c(Cl-),则c(H+)=c(OH-),则溶液显中性;
因体积、浓度相同的稀盐酸和氨水混合,溶液中的溶质为氯化铵,溶液呈酸性,若该溶液恰好呈中性,氨水应稍微过量,所以氨水的浓度大于盐酸的浓度,
故答案为:中;>;
(4)15g乙烷的物质的量为:$\frac{15g}{30g/mol}$=0.5mol,0.5mol燃烧放出aakJ的热量,则1mol乙烷燃烧放出2aKJ热量,2mol乙烷燃烧放出4aKJ热量,生成水为液体水,且△<0,正确的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-4akJ/mol,只有C符合,
故答案为:C;
(5)①根据反应方程式知,甲装置是一个燃料电池,所以甲是把化学能转变为电能的装置,是原电池;乙有外加电源,所以是电解池.根据2CH3OH+3O2+4KOH=2K2CO3+6H2O知,CH3OH发生氧化反应,所以该电极是负极,O2发生还原反应,所以该电极是正极,石墨与原电池的正极相连,所以B石墨电极是阳极,
故答案为:阳极;
②根据2CH3OH+3O2+4KOH=2K2CO3+6H2O知,CH3OH发生氧化反应,所以该电极是负极,O2得电子和水反应生成氢氧根离子,发生还原反应,所以该电极是正极;石墨与原电池的正极相连,所以石墨电极是阳极该电极上发生氧化反应,电极反应为:O2+2H2O+4e-=4OH-;Pt电极是阴极,该电极上银离子得电子发生还原反应,电极反应为:4Ag++4e-=4Ag;
故答案为:O2+2H2O+4e-=4OH-;4Ag++4e-=4Ag;
③乙池中离子放电顺序为:阳离子 Ag+>H+,阴离子OH->NO3-,阴极电极反应为:O2+2H2O+4e-=4OH-;阳极电极反应为:4Ag++4e-=4Ag;依据电子守恒和电解的实质写出化学方程式:4AgNO4+2H2O $\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,
故答案为:4AgNO4+2H2O $\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
点评 本题考查了原电池、电解池工作原理及其应用、热化学方程式的判断、难溶物溶解平衡的应用、酸碱混合的定性判断等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意掌握原电池、电解池工作原理,明确热化学方程式的书写原则、酸碱混合的定性判断方法,能够正确书写热化学方程式.

| A. | 该电池的正极是Ag2O,负极是Zn | |
| B. | 该电池负极的电极反应式为:Zn+2OH--2e-═ZnO+H2O | |
| C. | 理论上该电池工作一段时间后,溶液中KOH的浓度不变 | |
| D. | 该电池工作时,电解质中的阴离子向正极移动 |
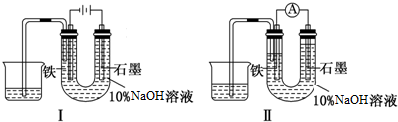
| A. | 装置I中石墨电极处得到气体的体积比铁电极处得到气体的体积大 | |
| B. | 用装置Ⅱ进行实验时铁电极的电极反应为 Fe-2e-+2OH-═Fe(OH)2↓ | |
| C. | 用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-═H2↑ | |
| D. | 装置I通电10分钟后,溶液的pH降低 |
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大 |
| A. | 单位时间内生成n mol O2的同时生成n mol NO2 | |
| B. | 混合气体的颜色不再改变的状态 | |
| C. | ν(NO2):ν(NO):ν(O2)=2:2:1的状态 | |
| D. | 混合气体的密度不再改变的状态 |

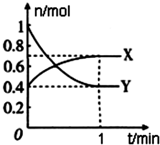 在一定温度下,体积为4L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为4L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.