题目内容
9.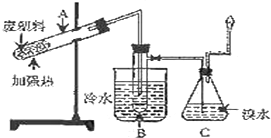 某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.
某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.该研究小组在实验中测得加热聚丙烯废塑料所得的产物如下表:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$乙炔$\stackrel{③}{→}$聚乙炔该转化流程中,第②步反应的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑.
(2)试管B中收集到油状液体,其中的一种成分D能使酸性高锰酸钾溶液褪色.D与氯气在光照条件下生成一氯取代物的化学方程式为
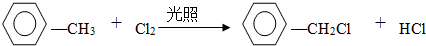 .
.(3)锥形瓶C中的现象是有气泡,溶液颜色渐渐褪去,气体经过锥形瓶C中的溴水充分吸收后再经干燥,所得气体的平均相对分子质量为4.8.
(4)C中逸出的气体在工业上可用作(至少两点)可做燃料、做化工生产原料.
分析 废塑料隔绝空气加强热,由表中数据可知生成甲烷、乙烯、丙烯、苯、甲苯、碳等,在B中冷却,B中收集到苯、甲苯,C为溴水,可吸收乙烯、丙烯,燃烧的气体主要为甲烷、氢气,
(1)电石与水反应生成氢氧化钙和乙炔;
(2)B中收集苯、甲苯,甲苯与高锰酸钾发生氧化还原反应,与氯气在光照条件下发生取代反应,取代甲基上的氢原子;
(3)根据进入锥形瓶C的气体乙烯、丙烯能使溴水褪色分层,剩余气体为氢气、甲烷;
(4)C中逸出的气体为氢气和甲烷,可用作燃料、化工原料等.
解答 解:废塑料隔绝空气加强热,由表中数据可知生成甲烷、乙烯、丙烯、苯、甲苯、碳等,在B中冷却,B中收集到苯、甲苯,C为溴水,可吸收乙烯、丙烯,燃烧的气体主要为甲烷、氢气,
(1)碳化钙与水反应生成乙炔和氢氧化钙,化学反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)B中收集苯、甲苯,甲苯与高锰酸钾发生氧化还原反应,与氯气在光照条件下发生取代反应,取代甲基上的氢原子,方程式为 ,
,
故答案为: ;
;
(3)因乙烯、丙烯能使溴水褪色分层,经溴水充分吸收再干燥后,剩余两种气体的成份为氢气和甲烷,设混合气体的质量为100g,则氢气的质量为12g,物质的量为6mol,甲烷的质量为24g,物质的量为1.5mol,V(H2):V(CH4)=4:1,所以气体干燥后的平均相对分子质量=$\frac{2×4+1×16}{5}$=4.8,
故答案为:有气泡,溶液颜色渐渐褪去;4.8;
(4)C中逸出的气体为氢气和甲烷,可做燃料、做化工生产原料,故答案为:可做燃料、做化工生产原料.
点评 本题考查物质的性质实验探究,侧重于化学的分析、实验和计算能力的考查,为高频考点,注意把握提给信息和相关数据,结合有机物的性质解答该题,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | Na2SO4 | B. | NaOH | C. | HNO3 | D. | FeO |
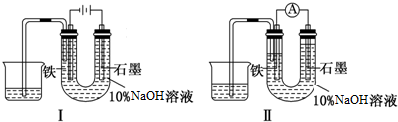
| A. | 装置I中石墨电极处得到气体的体积比铁电极处得到气体的体积大 | |
| B. | 用装置Ⅱ进行实验时铁电极的电极反应为 Fe-2e-+2OH-═Fe(OH)2↓ | |
| C. | 用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-═H2↑ | |
| D. | 装置I通电10分钟后,溶液的pH降低 |
| A. | 单位时间内生成n mol O2的同时生成n mol NO2 | |
| B. | 混合气体的颜色不再改变的状态 | |
| C. | ν(NO2):ν(NO):ν(O2)=2:2:1的状态 | |
| D. | 混合气体的密度不再改变的状态 |
| A. | Al3+、SO42-、Cl- | B. | Na+、AlO2- K+、SO42- | ||
| C. | MnO${\;}_{4}^{-}$、K+、SO42-、Na+ | D. | NH4+、NO3-、Fe2+、Cl- |
| A. | 植物油和乙醇 | B. | 苯和水 | C. | 酒精和水 | D. | 汽油和煤油 |
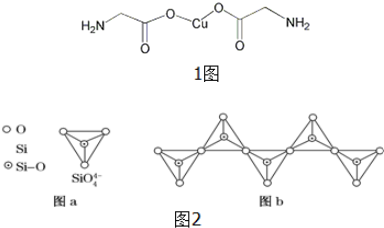

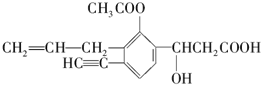 某有机化合物结构如下,分析其结构并完成下列问题:
某有机化合物结构如下,分析其结构并完成下列问题: