题目内容
7.已知X、Y为有刺激性气味的气体,有以下转化关系,部分产物未标出.
试回答:
(1)写出下列物质的化学式YSO2、CFeCl3.
(2)反应①的离子方程式为SO2+Cl2+2H2O=SO42-+4H+2Cl-,反应②的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
分析 A与硝酸银溶液、稀硝酸生成白色沉淀可知A中含有Cl-;B与氯化钡溶液、盐酸生成白色沉淀可知B中含有SO42-;X、Y、H2O生成Cl-和SO42-且X、Y均是有刺激性气味的气体可推知X、Y是二氧化硫和氯气,反应为SO2+Cl2+2H2O=H2SO4+2HCl;X能与铁反应可知X为Cl2,则C为FeCl3、Y为SO2,二氧化硫通入氯化铁溶液生成氯化亚铁、硫酸和盐酸,则A为HCl,B为H2SO4,结合对应物质的性质以及题目要求解答该题.
解答 解:A与硝酸银溶液、稀硝酸生成白色沉淀可知A中含有Cl-;B与氯化钡溶液、盐酸生成白色沉淀可知B中含有SO42-;X、Y、H2O生成Cl-和SO42-且X、Y均是有刺激性气味的气体可推知X、Y是二氧化硫和氯气,反应为SO2+Cl2+2H2O=H2SO4+2HCl;X能与铁反应可知X为Cl2,则C为FeCl3、Y为SO2,二氧化硫通入氯化铁溶液生成氯化亚铁、硫酸和盐酸,则A为HCl,B为H2SO4,
(1)由以上分析可知Y为SO2,C为FeCl3,故答案为:SO2;FeCl3;
(2)反应①X、Y是二氧化硫和氯气,反应离子方程式为:SO2+Cl2+2H2O=SO42-+4H+2Cl-,反应②二氧化硫通入氯化铁溶液生成氯化亚铁、硫酸和盐酸,反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,
故答案为:SO2+Cl2+2H2O=SO42-+4H+2Cl-;2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合运用的考查,注意本题推出A中含有Cl-、B中含有SO42-后逆推X、Y要联想X、Y应是含有Cl和S的有刺激性气味的气体,常见的为Cl2和SO2,难度中等.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案| A. | 单位时间内生成n mol O2的同时生成n mol NO2 | |
| B. | 混合气体的颜色不再改变的状态 | |
| C. | ν(NO2):ν(NO):ν(O2)=2:2:1的状态 | |
| D. | 混合气体的密度不再改变的状态 |
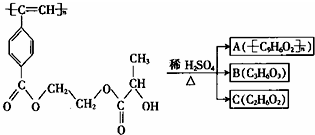
| A. | M和A均能使酸性KMnO4溶液和溴水褪色 | |
| B. | B(C3H6O3)能发生消去反应和酯化反应 | |
| C. | 1mol M与足量热的烧碱溶液反应,最多可消耗2n mol NaOH | |
| D. | A、B、C各1mol分别与足量金属钠反应,放出气体的物质的量之比为1:2:2 |
| A. | 植物油和乙醇 | B. | 苯和水 | C. | 酒精和水 | D. | 汽油和煤油 |
| A. | 石油常压分馏可得直馏汽油,石油汽可用作石油裂化的原料 | |
| B. | 石油裂解的目的是为了得到乙烯、丙烯和甲烷等化工原料 | |
| C. | 煤的干馏发生了物理变化,石油的减压分馏是化学变化 | |
| D. | 煤中含有苯和甲苯,可以通过先干馏后分馏的方法得到苯和甲苯 |
| A. | NH3中氮原子为sp2杂化,而CH4中碳原子是sp3杂化 | |
| B. | NH3中N原子形成三个杂化轨道,CH4中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 | |
| D. | NH3分子中有三个σ键,而甲烷分子中有四个σ键 |
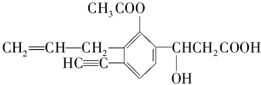 某有机化合物结构如下,分析其结构并完成下列问题:
某有机化合物结构如下,分析其结构并完成下列问题: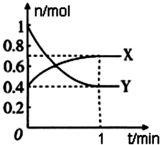 在一定温度下,体积为4L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为4L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.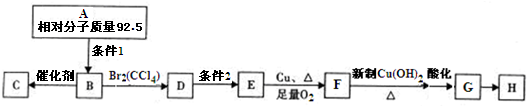
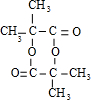 .
. ;
;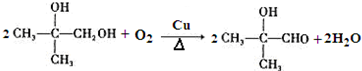 .
. )的合成路线为
)的合成路线为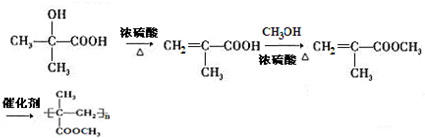 .
.