题目内容
14.(1)实验室用二氧化锰跟浓盐酸在加热条件下反应制取氯气;高锰酸钾是常用氧化剂,用高锰酸钾跟浓盐酸反应在室温下也能制氯气,方程式为:2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O
先配平该方程式,再用单线桥标出该反应中电子转移的方向和数目
该反应方程式中氧化剂是KMnO4(填化学式),氧化产物是Cl2(填化学式).作氧化剂与作还原剂的物质的量之比为1:5
(2)在常温下,发生下列几种反应:
①16H++10Z-+2XO4-═2X2++5Z2+8H2O
②2A2++B2═2A3++2B-
③2B-+Z2═B2+2Z-
根据上述反应,XO4-、Z2、B2、A3+氧化性从强到弱的顺序为:XO4->Z2>B2>A3+.
分析 (1)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,HCl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数;根据方程式确定转移电子数目,单线桥由提供电子的物质(元素)指向得电子的物质(元素);所含元素化合价降低的反应物是氧化剂,元素化合价升高被氧化是还原剂生成氧化产物;
(2)利用氧化剂的氧化性大于氧化产物的氧化性来分析.
解答 解:(1)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,HCl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O;在氧化还原反应2KMnO4+16HCl═2KC1+2MnC12+5Cl2↑+8H2O中,化合价升高元素Cl失电子,化合价降低的Mn元素得到电子,得失电子数相等为10,电子转移情况如下: ;反应中Mn元素化合价由KMnO4中+7降低为MnCl2中+2,故KMnO4是氧化剂,16mol中有10molHCl中的Cl元素化合价由-1价升高为0价,被氧化为还原剂,生成氯气为氧化产物,所以氧化剂与作还原剂的物质的量之比为2:10=1:5;
;反应中Mn元素化合价由KMnO4中+7降低为MnCl2中+2,故KMnO4是氧化剂,16mol中有10molHCl中的Cl元素化合价由-1价升高为0价,被氧化为还原剂,生成氯气为氧化产物,所以氧化剂与作还原剂的物质的量之比为2:10=1:5;
故答案为:2;16;2;2;5;8; ;KMnO4; Cl2;1:5;
;KMnO4; Cl2;1:5;
(2)①中X的化合价降低,则氧化性XO4->Z2,②中B元素的化合价降低,则氧化性B2>A3+,③中Z元素的化合价降低,则氧化性Z2>B2,则氧化性XO4->Z2>B2>A3+,故答案为:XO4->Z2>B2>A3+.
点评 本题考查氧化还原反应配平、计算及基本概念以及氧化性的强弱比较等,难度不大,注意掌握常用氧化还原反应的配平方法以及氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性解答的关键.

| A. | 过氧化钠的电子式: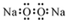 | B. | 中子数为 20 的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 硫离子的结构示意图: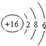 | D. | HCN的结构式:H-C≡N |
| 实验编号 | 实验步骤 | 实验现象 |
| ② | 加入AgNO3溶液 | 有沉淀产生 |
| ③ | 加入足量NaOH溶液后加热 | 收集气体0.896L(标准状况) |
| ④ | 加入足量的BaCl2 溶液 | 得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g |
| A. | c(K+)≥0.2 mol/L | |
| B. | 一定存在的离子:Cl-、NH4+、CO32-、SO42- | |
| C. | 一定不存在的离子:Ca2+、K+、Cl- | |
| D. | c(K+)+c(NH4+)=c(CO32-)+c(SO42-) |
| A. | Na2SO4 | B. | NaOH | C. | HNO3 | D. | FeO |
| 实验编号 | 盐酸浓度 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| ① | 1mol/L | 15 | 200 |
| ② | 1mol/L | 25 | 90 |
| ③ | 2mol/L | 25 | 10 |
该反应的离子方程式为:(2)Zn+2H+=Zn2++H2↑.
Ⅱ.实验②和③表明:(3)盐酸浓度越大,化学反应速率越大;
Ⅲ.除上述条件的改变引起速率的改变外,还可能有那些因素加快上述反应速率:
(4)锌的颗粒大小(列举其中一个因素)
Ⅳ.如果把实验③中锌片换成相同质量的铁片,请比较两种金属中那种产生的氢气多并说明原因:
(5)铁产生的氢气多,铁的摩尔质量小于锌,相同质量的铁锌,铁的物质的量多,失电子多(每摩尔铁锌均失2mole-).
| A. | 单位时间内生成n mol O2的同时生成n mol NO2 | |
| B. | 混合气体的颜色不再改变的状态 | |
| C. | ν(NO2):ν(NO):ν(O2)=2:2:1的状态 | |
| D. | 混合气体的密度不再改变的状态 |

 ⑥
⑥
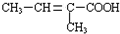 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
 中任意两种.
中任意两种.