题目内容
5.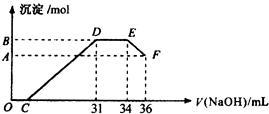 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低(如生成NO、N2O、N2、NH4+等).现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.则
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低(如生成NO、N2O、N2、NH4+等).现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.则(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为:H++OH-=H2O.
(2)B与A的差值为:0.008 mol.
(3)B点对应的沉淀的物质的量为:0.032 mol,C点对应的NaOH溶液的体积为7 mL.
分析 铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,
则随着NaOH的滴加,发生的反应依次有:
O-C:H++OH-=H2O,
C-D:Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,
D-ENH4++OH-═NH3•H2O,
E-F:Al(OH)3+OH-=AlO2-+2H2O;
(1)根据分析可知,OC段为氢离子与氢氧根离子反应生成水;
(2)可根据Al(OH)3+OH-=AlO2-+2H2O,得出Al(OH)3的物质的量为,B与A的差值即为氢氧化铝的物质的量;
(3)沉淀的总量可根据NH4+的量,根据NH4++OH-═NH3•H2O 得出n(NH4+),根据氧化还原反应,N元素由+5价变为-3价,而金属都由0价变为+3价,可以运用电子守恒得出金属的物质的量;根据消耗NaOH的总体积,结合在D点氢氧化钠与硝酸、铝铁离子的反应,可计算得出C点氢氧化钠溶液的体积.
解答 解:铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,
则随着NaOH的滴加,发生的反应依次有:
O-C:H++OH-=H2O,
C-D:Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,
D-ENH4++OH-═NH3•H2O,
E-F:Al(OH)3+OH-=AlO2-+2H2O
(1)根据分析可知,O-C发生反应的离子方程式为:H++OH-=H2O,
故答案为:H++OH-=H2O;
(2)根据Al(OH)3+OH-=AlO2-+2H2O,得出Al(OH)3的物质的量为:(36-34)×10-3L×4mol/L=0.008 mo,B与A的差值即为氢氧化铝沉淀的物质的量,
故答案为:0.008;
(3)沉淀的总量可根据NH4+的量,根据NH4++OH-═NH3•H2O得出:n(NH4+)=(34-31)×10-3L×4mol/L=0.012 mol,
根据氧化还原反应,N元素由+5价变为-3价,而金属都由0价变为+3价,可以运用电子守恒得出金属的物质的量为:$\frac{0.012mol×8}{3}$=0.032mol;
滴加NaOH体积为31mL时,发生反应为①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,
可计算得出C点氢氧化钠溶液的体积为:31mL-$\frac{0.032mol×3}{4mol/L}$×103ml/L=7mL,
故答案为:0.032;7.
点评 本题考查金属与硝酸的反应、离子方程式的书写、氧化还原反应、化学计算等知识点,属于中等难度试题,解答此题关键是判断出硝酸的还原产物以及电子转移守恒的运用.

| 实验编号 | 盐酸浓度 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| ① | 1mol/L | 15 | 200 |
| ② | 1mol/L | 25 | 90 |
| ③ | 2mol/L | 25 | 10 |
该反应的离子方程式为:(2)Zn+2H+=Zn2++H2↑.
Ⅱ.实验②和③表明:(3)盐酸浓度越大,化学反应速率越大;
Ⅲ.除上述条件的改变引起速率的改变外,还可能有那些因素加快上述反应速率:
(4)锌的颗粒大小(列举其中一个因素)
Ⅳ.如果把实验③中锌片换成相同质量的铁片,请比较两种金属中那种产生的氢气多并说明原因:
(5)铁产生的氢气多,铁的摩尔质量小于锌,相同质量的铁锌,铁的物质的量多,失电子多(每摩尔铁锌均失2mole-).
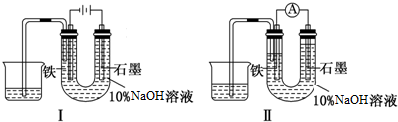
| A. | 装置I中石墨电极处得到气体的体积比铁电极处得到气体的体积大 | |
| B. | 用装置Ⅱ进行实验时铁电极的电极反应为 Fe-2e-+2OH-═Fe(OH)2↓ | |
| C. | 用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-═H2↑ | |
| D. | 装置I通电10分钟后,溶液的pH降低 |
| A. | 用稀硝酸处理铁片 | B. | 用稀盐酸处理铁片 | ||
| C. | 用浓硝酸处理铁片 | D. | 用浓盐酸处理铁片 |
| A. | 单位时间内生成n mol O2的同时生成n mol NO2 | |
| B. | 混合气体的颜色不再改变的状态 | |
| C. | ν(NO2):ν(NO):ν(O2)=2:2:1的状态 | |
| D. | 混合气体的密度不再改变的状态 |
| A. | Al3+、SO42-、Cl- | B. | Na+、AlO2- K+、SO42- | ||
| C. | MnO${\;}_{4}^{-}$、K+、SO42-、Na+ | D. | NH4+、NO3-、Fe2+、Cl- |
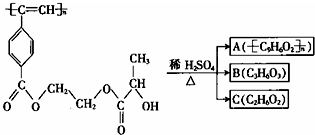
| A. | M和A均能使酸性KMnO4溶液和溴水褪色 | |
| B. | B(C3H6O3)能发生消去反应和酯化反应 | |
| C. | 1mol M与足量热的烧碱溶液反应,最多可消耗2n mol NaOH | |
| D. | A、B、C各1mol分别与足量金属钠反应,放出气体的物质的量之比为1:2:2 |
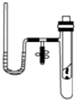 某研究性学习小组在探究化学反应中的能量变化时设计了如图所示的实验装置.
某研究性学习小组在探究化学反应中的能量变化时设计了如图所示的实验装置.