题目内容
6.下列“假说“在化学科学发展过程中曾经起到一定的作用,至今仍公认为化学原理的是( )| A. | 1803 年道尔顿提出的“元素的原子以其原子质量为特征” | |
| B. | 1808 年盖•吕萨克提出的“同温同压下,相同体积的不同气体含有相同数目的原子” | |
| C. | 1811 年贝来里乌斯提出的“不同原子显不同电性,因而产生吸引力形成化合物“ | |
| D. | 1887 年阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电的粒子” |
分析 A.根据原子的构成可知,质子数决定元素的种类;
B.在同温同压下,相同体积的不同气体含有相同数目的分子;
C.根据原子不带电,离子化合物是由离子构成的来分析;
D.根据电解质的电离来分析.
解答 解:A.因质子数决定元素的种类,则每一元素的原子以质子数为特征,则道尔顿提出的“以其原子质量为其特征”不科学,故A错误;
B.在同温同压下,相同体积的不同气体含有相同数目的分子,相同的分子数不一定具有相同的原子数,如氧气和臭氧等,则盖•吕萨克提出的理论不科学,故B错误;
C.因原子不带电,带相反电荷的离子可构成化合物,则贝采里乌斯提出的理论不科学,故C错误;
D.阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电的粒子”与电解质的电离是相同的,即该理论科学,故D正确.
故选D.
点评 本题以化学的发展中的假说来考查学生对原子的构成、电解质的电离、离子化合物的形成及物质的构成等知识的认识,学生应注意理论的发展性及理论的局限性、时代性来分析解答.

练习册系列答案
相关题目
5.下列有关油脂的叙述不正确的是( )
①油脂是高级脂肪酸和甘油所生成的酯
②油脂属于酯类
③油脂都能发生氢化反应
④某油脂分子中,所含烃基有三种,但每一个油脂分子中所含的三种烃基都相同,而且排列结构也相同,则该油脂为混合物
⑤天然油脂没有固定的熔点和沸点,所以天然油脂是混合物.
①油脂是高级脂肪酸和甘油所生成的酯
②油脂属于酯类
③油脂都能发生氢化反应
④某油脂分子中,所含烃基有三种,但每一个油脂分子中所含的三种烃基都相同,而且排列结构也相同,则该油脂为混合物
⑤天然油脂没有固定的熔点和沸点,所以天然油脂是混合物.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ④⑤ |
6.下列说法不正确的是( )
| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同 | |
| C. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 | |
| D. | Mg(OH)2固体在溶液存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 |
3.下列说法正确的是( )
| A. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 | |
| B. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 | |
| C. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
11.稀土是一种不可再生的战略性资源,被广泛应用于电子信息、国防军工等多个领域.一种从废弃阴极射线管(CRT)荧光粉中提取稀土元素钇(Y)的工艺流程如图1:

已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如表所示;
②不同离子沉淀的pH如图2所示.
(1)步骤Ⅰ中进行原料预处理的目的为除去ZnO和Al2O3;富集稀土元素;降低后续耗酸量.
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HClPbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤Ⅴ中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;Ksp[Y2(C2O4)3]=8.0×10-25)
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3Y2O3+3CO↑+3CO2↑.

已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如表所示;
②不同离子沉淀的pH如图2所示.
| 阶段/含量%/成分 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HClPbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤Ⅴ中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;Ksp[Y2(C2O4)3]=8.0×10-25)
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3Y2O3+3CO↑+3CO2↑.
18.已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )
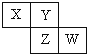

| A. | Z单质的化学活泼性一定比Y单质的强 | |
| B. | W的原子序数可能是Y的原子序数的2倍 | |
| C. | W的气态氢化物的稳定性一定比Y的强 | |
| D. | X和W两元素不可能形成共价化合物 |
15. A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )
A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )
 A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )
A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )| A. | C的氯化物与水反应,可生成白色烟雾 | |
| B. | A的氧化物对应的水化物一定为强酸 | |
| C. | D的最高价氧化物对应的水化物能和D的氢化物发生反应生成盐 | |
| D. | 向含B元素的盐溶液中滴加碳酸氢钠溶液,可能不出现白色沉淀 |
16.下列各项实验的基本操作中,正确的是( )
| A. | 为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体 | |
| B. | 为了防止容量瓶漏液,可在玻璃塞上涂上凡士林 | |
| C. | 为了使制取氢气的速率加快,可向稀硫酸中加入少量硫酸铜溶液 | |
| D. | 为了使配制的FeCl3溶液不产生混浊,可加入盐酸和铁片 |