题目内容
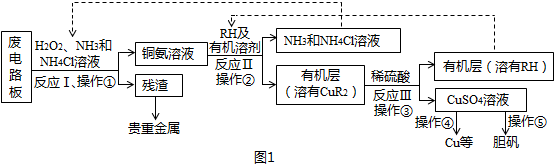
11.稀土是一种不可再生的战略性资源,被广泛应用于电子信息、国防军工等多个领域.一种从废弃阴极射线管(CRT)荧光粉中提取稀土元素钇(Y)的工艺流程如图1:
已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如表所示;
②不同离子沉淀的pH如图2所示.
| 阶段/含量%/成分 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤Ⅴ中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;Ksp[Y2(C2O4)3]=8.0×10-25)
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.
分析 废弃CRT荧光粉的化学组成为Y2O3、ZnO、Al2O3、PbO2、MgO等,加盐酸,过滤,滤渣主要含有Y2O3,还有少量的PbO2、ZnO、Al2O3、MgO,再加5mol/L的盐酸,PbO2与HCl发生氧化还原反应,生成氯气和PbCl2,Y2O3转化为Y3+,过滤,滤液中含有Pb2+和Y3+、Al3+、Zn2+、Mg2+,再加氨水,Al3+形成Al(OH)3沉淀,过滤,滤液中含有Pb2+和Y3+、Zn2+、Mg2+,加DDTC除去溶液中的Pb2+和Zn2+,过滤,滤液中加草酸,生成Y2(C2O4)3沉淀,过滤,滤渣为Y2(C2O4)3固体,高温灼烧Y2(C2O4)3生成Y2O3;
(1)进行原料预处理可以除去部分ZnO和Al2O3,富集稀土元素等;
(2)PbO2与HCl发生氧化还原反应,生成氯气和PbCl2,根据原子守恒和得失电子守恒写出方程式;
(3)步骤Ⅲ是用氨水除去溶液中的Al3+;
(4)根据流程分析;由图2可知Zn2+、Pb2+与Y3+沉淀的pH相近;
(5)根据Ksp[Y2(C2O4)3]=c2(Y3+)×c3(C2O42-)计算;
(6)草酸钇隔绝空气加热可以得到Y2O3和CO、CO2.
解答 解:废弃CRT荧光粉的化学组成为Y2O3、ZnO、Al2O3、PbO2、MgO等,加盐酸,过滤,滤渣主要含有Y2O3,还有少量的PbO2、ZnO、Al2O3、MgO,再加5mol/L的盐酸,PbO2与HCl发生氧化还原反应,生成氯气和PbCl2,Y2O3转化为Y3+,过滤,滤液中含有Pb2+和Y3+、Al3+、Zn2+、Mg2+,再加氨水,Al3+形成Al(OH)3沉淀,过滤,滤液中含有Pb2+和Y3+、Zn2+、Mg2+,加DDTC除去溶液中的Pb2+和Zn2+,过滤,滤液中加草酸,生成Y2(C2O4)3沉淀,过滤,滤渣为Y2(C2O4)3固体,高温灼烧Y2(C2O4)3生成Y2O3;
(1)由表格数据可知:进行原料预处理可以除去部分ZnO和Al2O3,富集稀土元素;在后续操作中能降低耗酸量等,
故答案为:除去ZnO和Al2O3;富集稀土元素;降低后续耗酸量;
(2)PbO2与HCl发生氧化还原反应,生成氯气和PbCl2,则反应的方程式为:PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O,
故答案为:PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(3)由流程分析可知,步骤Ⅲ是用氨水除去溶液中的Al3+,其反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(4)根据流程分析可知,步骤Ⅳ中除杂试剂DDTC除去的杂质离子有;由图2可知Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离,所以不能通过直接加碱的方法除去Zn2+、Pb2+;
故答案为:Zn2+、Pb2+;Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离;
(5)已知:当离子浓度小于10-5mol/L时,沉淀就达完全,Ksp[Y2(C2O4)3]=c2(Y3+)×c3(C2O42-)=(10-5)2×c3(C2O42-)=8.0×10-28,则c(C2O42-)=$\root{3}{\frac{8.0×1{0}^{-28}}{(1{0}^{-5})^{2}}}$=2.0×10-6mol/L,故答案为:2.0×10-6;
(6)草酸钇隔绝空气加热可以得到Y2O3和CO、CO2,其反应的方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑,故答案为:Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.
点评 本题考查了物质的分离提纯实验操作,题目涉及到氧化还原、出除杂质、溶度积常数的应用等,题目难度中等,注意根据题意写出有关反应的方程式,做题时注意根据物质的性质正确判断反应物和生成物,用守恒的方法去书写.

| A. | 纤维素、淀粉、脂肪、蛋白质都是高分子化合物 | |
| B. | 淀粉水解的最终产物都能发生银镜反应 | |
| C. | 误食重金属盐而引起的中毒可服用大量豆浆或牛奶进行解救 | |
| D. | 脂肪能发生皂化反应,生成甘油和高级脂肪酸钠 |
| A. | 1803 年道尔顿提出的“元素的原子以其原子质量为特征” | |
| B. | 1808 年盖•吕萨克提出的“同温同压下,相同体积的不同气体含有相同数目的原子” | |
| C. | 1811 年贝来里乌斯提出的“不同原子显不同电性,因而产生吸引力形成化合物“ | |
| D. | 1887 年阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电的粒子” |

| A. | 2H(g)+2X(g)═2HX(g)△H3<0 | |
| B. | △H1=△H2+△H3 | |
| C. | Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量按Cl、Br、I的顺序依次增多 | |
| D. | 途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 |
 直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )
直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )| A. | 电子经外电路自b极流向a极 | |
| B. | b极的电极半反应为O2+4e-+4H+=2H2O | |
| C. | 质子交换膜中的H+流向a极 | |
| D. | 以此电池供电,电解CuSO4溶液,理论上每生成0.1molCu最少需要氧气1.12L |
①2CH4 (g)+O2 (g)═2CO(g)+4H2(g)△H=-71.0 kJ•mol-1;
②CO(g)+2H2 (g)═CH3OH(l)△H=-90.5kJ•mol-1;
下列描述错误的是( )
| A. | 反应①中的能量变化如图所示: | |
| B. | CO(g)+2H2 (g)═CH3OH(g)△H<-90.5kJ•mol-1 | |
| C. | 2CH4 (g)+3O2 (g)═2CO(g)+4H2O(g)△H<-71.0kJ•mol-1 | |
| D. | 2CH4 (g)+$\frac{1}{2}$O2 (g)═CH3OH( l))△H=-126.0kJ•mol-1 |
| A. |  装置可收集NO气体 | |
| B. |  装置可吸收多余氨气且能防止倒吸 | |
| C. |  装置可实现反应:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | |
| D. | 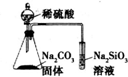 装置可证明非金属性:S>C>Si |