题目内容
3.下列说法正确的是( )| A. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 | |
| B. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 | |
| C. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
分析 A.H2O2分解产生1molO2,反应中O元素化合价由-1价升高到0价,转移2mol电子;
B.CH3COOH为弱酸,pH=3的CH3COOH溶液与pH=11的NaOH溶液相比较,醋酸过量;
C.用牺牲阳极或外加电流的阴极保护法,铁分别为正极和阴极;
D.化学反应中速率之比等于计量数之比.
解答 解:A.H2O2分解产生1molO2,方程式为2H2O2↑$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,反应中O元素化合价由-1价升高到0价,转移2mol电子,故A错误;
B.CH3COOH为弱酸,pH=3的CH3COOH溶液与pH=11的NaOH溶液相比较,醋酸过量,等体积混合后溶液呈酸性,pH<7,故B错误;
C.用牺牲阳极或外加电流的阴极保护法,铁分别为正极和阴极,都发生还原反应,可防止被氧化,故C正确;
D.一定条件下反应N2+3H2?2NH3反应,速率关系符合系数比,即v正(H2):v正(NH3)=3:2,当反应达到平衡时,v正(NH3)=v逆(NH3),则达到平衡时,应为2v正(H2)=3v逆(NH3),故D错误.
故选C.
点评 本题为2015年江苏考题第11题,综合考查氧化还原反应、弱电解质的电离、金属的腐蚀与防护以及化学平衡等问题,侧重于学生的分析能力的考查,注意相关基础知识的积累,题目难度适中,贴近教材,有利于培养和考查学生的良好的学习习惯和科学素养.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案
相关题目
13.下列说法不正确的是( )
| A. | 医院里消毒用的来苏水,其主要成分是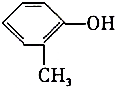 ,它属于酚类 ,它属于酚类 | |
| B. | 护肤用的甘油( )属于三元醇 )属于三元醇 | |
| C. | 冬天汽车里用的防冻液是乙醇 | |
| D. | 含有-OH(羟基)官能团的有机物不一定是醇类 |
18.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
6.下列“假说“在化学科学发展过程中曾经起到一定的作用,至今仍公认为化学原理的是( )
| A. | 1803 年道尔顿提出的“元素的原子以其原子质量为特征” | |
| B. | 1808 年盖•吕萨克提出的“同温同压下,相同体积的不同气体含有相同数目的原子” | |
| C. | 1811 年贝来里乌斯提出的“不同原子显不同电性,因而产生吸引力形成化合物“ | |
| D. | 1887 年阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电的粒子” |
3. 直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )
直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )
 直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )
直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )| A. | 电子经外电路自b极流向a极 | |
| B. | b极的电极半反应为O2+4e-+4H+=2H2O | |
| C. | 质子交换膜中的H+流向a极 | |
| D. | 以此电池供电,电解CuSO4溶液,理论上每生成0.1molCu最少需要氧气1.12L |
 .
.
 .
.