题目内容
【题目】甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应反应来制备甲醇.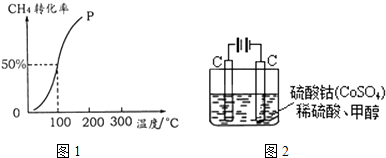
I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 (g )△H=+206.0kJmol﹣1
II:CO ( g )+2H2 ( g )=CH3OH ( g )△H=﹣129.0kJmol﹣1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 .
(2)将1.0molCH4和2.0molH2O (g )通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 .
②100℃时反应I的平衡常数为 .
(3)在压强为0.1Mpa、温度为300℃条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填字母序号).
,其他条件不变,对平衡体系产生的影响是 (填字母序号).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.c ( H2 )/c (CH3OH )减小
E.平衡常数K增大
(4)写出甲醇﹣空气﹣KOH溶液的燃料电池负极的电极反应式: .
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这污染,其原理如图2.通电后,Co2+放电变为Co3+ , 然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.①写出阳极电极反应式 .
②写出除去甲醇的离子方程式 .
【答案】
(1)CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0 kJ/mol
(2)0.003mol?L﹣1?min﹣1;2.25×10﹣4
(3)CD
(4)CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O
(5)Co2+﹣e﹣=Co3+;6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
【解析】解:(1)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol ②CO(g)+2H2(g)=CH3OH(g)△H=+129.0kJ/mol将方程式①﹣②得CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+206.0kJ/mol﹣(﹣129.0kJ/mol)=+77.0 kJ/mol,故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0kJ/mol;(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO(g)+3H2 (g)
起始量(mol):1.0 2.00 0
变化量(mol):0.5 0.50.5 1.5
平衡量(mol):0.5 1.50.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率= ![]() =0.003 molL﹣1min﹣1 , 故答案为:0.003 molL﹣1min﹣1;②100℃时反应I的平衡浓度为c(CH4)=0.050mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,平衡常数K=
=0.003 molL﹣1min﹣1 , 故答案为:0.003 molL﹣1min﹣1;②100℃时反应I的平衡浓度为c(CH4)=0.050mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,平衡常数K= ![]() =2.25×10﹣4 , 故答案为:2.25×10﹣4;(3)A.平衡后将容器的容积压缩到原来的
=2.25×10﹣4 , 故答案为:2.25×10﹣4;(3)A.平衡后将容器的容积压缩到原来的 ![]() ,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故A错误; B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误; C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确; D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡
,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故A错误; B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误; C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确; D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡 ![]() 减小,故D正确; E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误,故答案为:CD;(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水,负极电极反应式为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O,故答案为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O;(5)①通电后,将Co2+氧化成Co3+ , 电解池中阳极失电子发生氧化反应,电极反应为Co2+﹣e﹣=Co3+ , 故答案为:Co2+﹣e﹣=Co3+;②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+ , 结合原子守恒与电荷守恒可知,还原生成H+ , 配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+ , 故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+ .
减小,故D正确; E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误,故答案为:CD;(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水,负极电极反应式为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O,故答案为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O;(5)①通电后,将Co2+氧化成Co3+ , 电解池中阳极失电子发生氧化反应,电极反应为Co2+﹣e﹣=Co3+ , 故答案为:Co2+﹣e﹣=Co3+;②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+ , 结合原子守恒与电荷守恒可知,还原生成H+ , 配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+ , 故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+ .
(1)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol ②CO(g)+2 H2(g)=CH3OH(g)△H=+129.0 kJ/mol将方程式①﹣②得;(2)100℃时达到平衡时,甲烷转化率为50%,结合化学平衡三段式列式计算平衡时各组分的物质的量,①根据c= ![]() 计算v(H2)②计算平衡状态时各物质的浓度,代入平衡常数表达式计算;(3)其他条件不变,平衡后将容器的容积压缩到原来的
计算v(H2)②计算平衡状态时各物质的浓度,代入平衡常数表达式计算;(3)其他条件不变,平衡后将容器的容积压缩到原来的 ![]() ,压强增大,正、逆反应速率都增大,但正反应速率增大更多,平衡向正反应方向移动,生成物的浓度增大,由于温度不变,则平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,据此分析解答;(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水;(5)①通电后,将Co2+氧化成Co3+ , 电解池中阳极失电子发生氧化反应,电极反应为Co2+﹣e﹣=Co3+;②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+ , 原子守恒与电荷守恒可知,还原生成H+ , 配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;③负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水;利用电池反应方程式2CH3OH+3O2+4KOH═2K2CO3+6H20分析.
,压强增大,正、逆反应速率都增大,但正反应速率增大更多,平衡向正反应方向移动,生成物的浓度增大,由于温度不变,则平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,据此分析解答;(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水;(5)①通电后,将Co2+氧化成Co3+ , 电解池中阳极失电子发生氧化反应,电极反应为Co2+﹣e﹣=Co3+;②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+ , 原子守恒与电荷守恒可知,还原生成H+ , 配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;③负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水;利用电池反应方程式2CH3OH+3O2+4KOH═2K2CO3+6H20分析.

 名题金卷系列答案
名题金卷系列答案