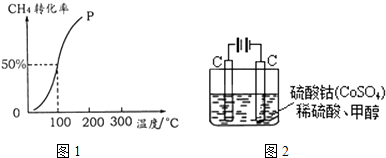
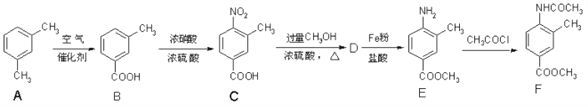
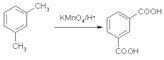
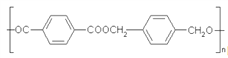
题目内容
【题目】工业上用废铁为主要原料生产黄色颜料氧化铁黄(化学式:FeOOH)的一种工艺流程如下:
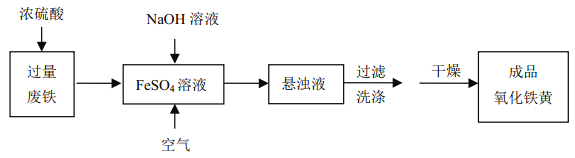
主要反应:4FeSO4+O2+8NaOH→4FeOOH↓+4Na2SO4+2H2O,完成下列填空:
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为___________________,钢铁的电化学保护有一种是外加电流阴极保护法,另一种是______________阴极保护法。
(2)废铁在反应前需清洗表面油污,请用水解平衡移动原理解释常用热的纯碱溶液清洗废铁表面油污的原因________________________________________________。
(3)FeSO4的氧化过程若温度太高会发生副反应而产生红褐色沉淀[Fe(OH)3],其离子方程式是_________________、 ___________________。
(4)检验氧化铁黄沉淀洗涤是否完全的方法是:向最后一次洗涤液中加入_______试剂,若出现_______现象则表明未洗涤完全。
【答案】 O2+2H2O +4e-→4OH- 牺牲阳极 CO32-+H2O![]() HCO3-+OH-,加热能促进纯碱水解,使 OH-浓度增大,增强了去油污的能力 Fe2++2OH-→Fe(OH)2↓ 4Fe(OH)2+O2+2H2O→4Fe(OH)3 BaCl2溶液 白色沉淀
HCO3-+OH-,加热能促进纯碱水解,使 OH-浓度增大,增强了去油污的能力 Fe2++2OH-→Fe(OH)2↓ 4Fe(OH)2+O2+2H2O→4Fe(OH)3 BaCl2溶液 白色沉淀
【解析】本题主要考查对于“工业上用废铁为主要原料生产黄色颜料氧化铁黄(化学式:FeOOH)的一种工艺流程”的评价。
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为O2+2H2O +4e-=4OH-,钢铁的电化学保护有一种是外加电流阴极保护法,另一种是牺牲阳极阴极保护法。
(2)用水解平衡移动原理解释常用热的纯碱溶液清洗废铁表面油污的原因:CO32-+H2O![]() HCO3-+OH-,加热能促进纯碱水解,使OH-浓度增大,增强了去油污的能力。
HCO3-+OH-,加热能促进纯碱水解,使OH-浓度增大,增强了去油污的能力。
(3)FeSO4的氧化过程若温度太高会发生副反应而产生红褐色沉淀[Fe(OH)3],其离子方程式是Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(4)氧化铁黄沉淀吸附悬浊液中的Na+、![]() 等离子,可以通过检验
等离子,可以通过检验![]() 的方法检验氧化铁黄沉淀洗涤是否完全,方法是:向最后一次洗涤液中加入BaCl2溶液,若出现白色沉淀现象则表明未洗涤完全。
的方法检验氧化铁黄沉淀洗涤是否完全,方法是:向最后一次洗涤液中加入BaCl2溶液,若出现白色沉淀现象则表明未洗涤完全。

 名师点拨卷系列答案
名师点拨卷系列答案