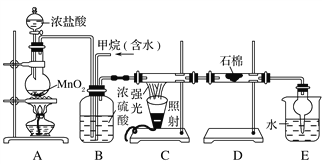
��Ŀ����
����Ŀ��25��ʱ����1mol NH4NO3����ˮ�������Һ�μ�b L��ˮ����Һ�����ԣ��ݴ��ж�����˵���в���ȷ���ǣ�NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5molL��1���� ��
A.�μӰ�ˮ�Ĺ����У�ˮ�ĵ���ƽ�⽫�����ƶ�
B.�μ�b L��ˮ�����Һ�У�n��NH ![]() ��=200 n��NH3?H2O��=1mol
��=200 n��NH3?H2O��=1mol
C.���μӰ�ˮ��Ũ��Ϊ0.005/b mol?L��1
D.�μ�b L��ˮ�����Һ�и�����Ũ�ȴ�С�ǣ�c��NH ![]() ��=c��NO3������c��H+��=c��OH����
��=c��NO3������c��H+��=c��OH����
���𰸡�A
���������⣺A��笠�����ˮ��ٽ�ˮ�ĵ��룬�������Һ��笠�����ˮ�������ԣ���Һ�м��백ˮ��������Һ������ˮ�ĵ��룬ˮ�ĵ���ƽ�������ƶ�����A����B����1molNH4NO3����ˮ�������Һ�μ�bL ��ˮ����Һ�����ԣ����ݵ���غ�����֪����Һ������������Ũ��=10��7mol/L��c��NH ![]() ��=c��NO3������NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5 molL��1 �� ���Ϻ���Һ���Ϊ1L����NH
��=c��NO3������NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5 molL��1 �� ���Ϻ���Һ���Ϊ1L����NH ![]() ��=c��NO3����=1mol/L������һˮ�ϰ�����ƽ��õ���NH3H2ONH4++OH�� �� ƽ�ⳣ��K=
��=c��NO3����=1mol/L������һˮ�ϰ�����ƽ��õ���NH3H2ONH4++OH�� �� ƽ�ⳣ��K= ![]() =
= 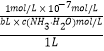 =2��10��5 molL��1 �� ����õ�c��NH3H2O��=
=2��10��5 molL��1 �� ����õ�c��NH3H2O��= ![]() mol/L��n��NH3H2O��=
mol/L��n��NH3H2O��= ![]() mol����NH
mol����NH ![]() ��=c��NO3����=1mol/L���μ�b L��ˮ�����Һ�У�n��NH
��=c��NO3����=1mol/L���μ�b L��ˮ�����Һ�У�n��NH ![]() ��=200 n��NH3H2O��=1mol����B��ȷ��
��=200 n��NH3H2O��=1mol����B��ȷ��
C����1mol NH4NO3����ˮ�������Һ�μ�bL ��ˮ����Һ�����ԣ����ݵ���غ�����֪����Һ������������Ũ��=10��7mol/L��c��NH ![]() ��=c��NO3������NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5 molL��1 �� ���Ϻ���Һ���Ϊ1L����NH
��=c��NO3������NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5 molL��1 �� ���Ϻ���Һ���Ϊ1L����NH ![]() ��=c��NO3����=1mol/L������һˮ�ϰ�����ƽ��õ���NH3H2ONH4++OH�� �� ƽ�ⳣ��K=
��=c��NO3����=1mol/L������һˮ�ϰ�����ƽ��õ���NH3H2ONH4++OH�� �� ƽ�ⳣ��K= ![]() =
= 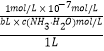 =2��10��5 molL��1 �� ����õ�c��NH3H2O��=
=2��10��5 molL��1 �� ����õ�c��NH3H2O��= ![]() mol/L����C��ȷ��
mol/L����C��ȷ��
D����Һ�д��ڵ���غ㣬c��NH4+��+c��H+��=c��OH����+c��NO3�������õ�c��NH ![]() ��=c��NO
��=c��NO ![]() ����c��H+��=c��OH�������õ�c��NH
����c��H+��=c��OH�������õ�c��NH ![]() ��=c��NO3������c��H+��=c��OH��������D��ȷ��
��=c��NO3������c��H+��=c��OH��������D��ȷ��
��ѡA��

 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�