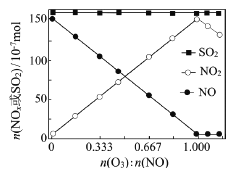
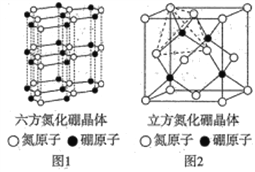
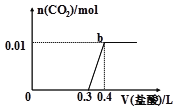
题目内容
【题目】Li-Cu-空气燃料电池的原理示意如图,电池通入空气腐蚀铜电极而产生正极反应物Cu2O。下列有关说法正确的是
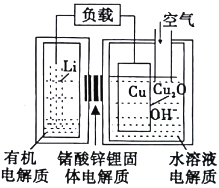
A. 电池工作时,正极上有金属锂析出
B. 电池工作时,负极区溶液中c(OH-)增大
C. 电池放电过程中的总反应为:2Cu+2Li++2OH-=2Li+Cu2O+H2O
D. 停止通入空气一段时间,电池将停止放电
【答案】D
【解析】A、电池工作时,正极发生反应为Cu2O+H2O+2e-=2OH-+2Cu,没有金属锂析出,选项A错误;B、负极为锂失电子生成Li+,负极区无水溶液,选项B错误;C、电池放电过程中的总反应为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,选项C错误;D、停止通入空气一段时间,铜电极不能再氧化生成Cu2O,当正极的Cu2O全部转化为Cu后,电池将停止放电,选项D正确。答案选D。

练习册系列答案
相关题目
【题目】用如图所示装置进行下列实验,将分液漏斗中溶液X加入圆底烧瓶中与Y反应,对试管B中现象描述不正确的是
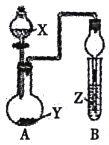
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
A | 70%H2SO4 | Na2SO3溶液 | H2S溶液 | 产生浑浊 |
B | 浓氨水 | CaO | 酚酞试剂 | 溶液变红 |
C | 盐酸 | 大理石 | Na2SiO3溶液 | 出现白色沉淀 |
D | 浓盐酸 | MnO2 | NaOH溶液 | 黄绿色气体被吸收 |
A. A B. B C. C D. D